よむ、つかう、まなぶ。
創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会 報告書 (21 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_39934.html |
| 出典情報 | 創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会 報告書の公表について(4/24)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
生労働科学特別研究事業「臨床試験が実施困難な希少疾患等に対する医薬品の迅速な
国内導入を図るための薬事承認審査制度の構築に向けた調査研究」の中間報告12が発
表された。米国の Accelerated Approval(AA)及び欧州の Conditional Marketing
Authorization の運用状況について調査結果が説明された。
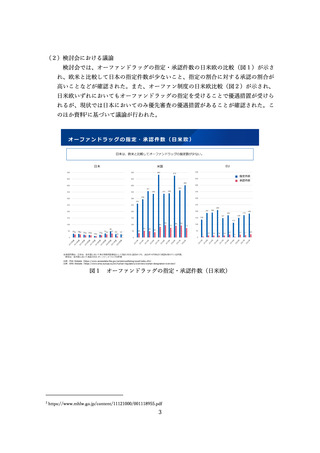
特に、米国の AA 承認と日本の承認の関係としては、米国 AA 承認を受けた 295 品
目のうち、日本で承認を受けている品目は 170 件あり、そのうち米国の Convert(本
承認)以前に承認を受けているものは 120 件あるなど、実態としては日本でも多くの
例で迅速承認相当の段階で通常の承認が行われていることが明らかとされた。
構成員からは、次のような意見が出た。
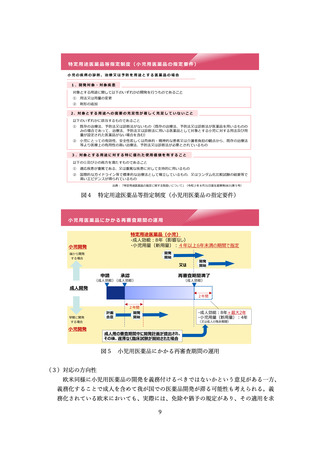
⚫ 現在でも多剤耐性菌の抗菌薬など、国内承認がなく、個人輸入せざるを得な
いものがある。そういったものに条件付き承認制度を活用して国内への導入
を図ることは重要。
⚫ 米国で Accelerated Approval を受けた品目のうち、 4割程度がアメリカ本承
認前に日本でも通常承認を受けていることをもって、日本の承認制度が機能
していると解釈するべきではない。その4割の品目であっても、米国の承認
から日本の承認までの期間は平均 800 日程度、中央値 500 日程度であり、短
くない。
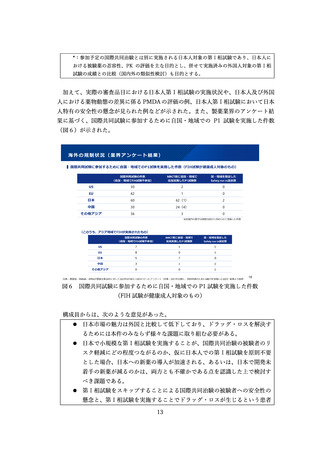
⚫ 日本では第Ⅱ相段階で通常承認をしており、その後積極的に評価を行う機会
を失ってしまっている。
⚫ 法改正後の運用実績はゼロであり、運用の見直しを検討してもよいのではな
いか。
⚫ 研究機関の期待感としては、法改正後の実績がないことは、残念。
⚫ 製造販売後の計画は、期間を含めて具体化する必要がある。
⚫ 必ずしも条件付き承認制度を活用しなくとも、通常の安全性監視活動により
対応できる場合もあるのではないか。
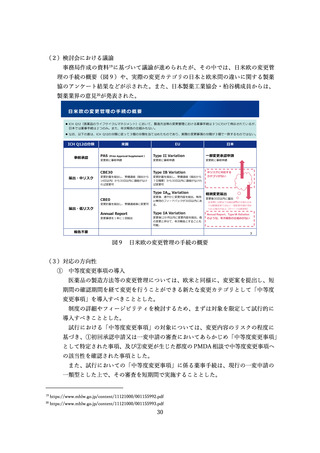
また、第2回目の議論において、米国の迅速承認の取消品目のうち日本で製造販売
中の品目などが追加で示された13。なお、資料中、米国の迅速承認の取消品目のうち
日本で製造販売中の品目は、対象患者や用法用量が米国の迅速承認と異なる内容で国
内承認されたものを含む。いずれの品目も、国内では、安全性、有効性を確認の上、
承認されている。
12
https://www.mhlw.go.jp/content/11121000/001177939.pdf
13
https://www.mhlw.go.jp/content/11121000/001206148.pdf
21
国内導入を図るための薬事承認審査制度の構築に向けた調査研究」の中間報告12が発
表された。米国の Accelerated Approval(AA)及び欧州の Conditional Marketing
Authorization の運用状況について調査結果が説明された。
特に、米国の AA 承認と日本の承認の関係としては、米国 AA 承認を受けた 295 品
目のうち、日本で承認を受けている品目は 170 件あり、そのうち米国の Convert(本
承認)以前に承認を受けているものは 120 件あるなど、実態としては日本でも多くの
例で迅速承認相当の段階で通常の承認が行われていることが明らかとされた。
構成員からは、次のような意見が出た。
⚫ 現在でも多剤耐性菌の抗菌薬など、国内承認がなく、個人輸入せざるを得な
いものがある。そういったものに条件付き承認制度を活用して国内への導入
を図ることは重要。
⚫ 米国で Accelerated Approval を受けた品目のうち、 4割程度がアメリカ本承
認前に日本でも通常承認を受けていることをもって、日本の承認制度が機能
していると解釈するべきではない。その4割の品目であっても、米国の承認
から日本の承認までの期間は平均 800 日程度、中央値 500 日程度であり、短
くない。
⚫ 日本では第Ⅱ相段階で通常承認をしており、その後積極的に評価を行う機会
を失ってしまっている。
⚫ 法改正後の運用実績はゼロであり、運用の見直しを検討してもよいのではな
いか。
⚫ 研究機関の期待感としては、法改正後の実績がないことは、残念。
⚫ 製造販売後の計画は、期間を含めて具体化する必要がある。
⚫ 必ずしも条件付き承認制度を活用しなくとも、通常の安全性監視活動により
対応できる場合もあるのではないか。
また、第2回目の議論において、米国の迅速承認の取消品目のうち日本で製造販売
中の品目などが追加で示された13。なお、資料中、米国の迅速承認の取消品目のうち
日本で製造販売中の品目は、対象患者や用法用量が米国の迅速承認と異なる内容で国
内承認されたものを含む。いずれの品目も、国内では、安全性、有効性を確認の上、
承認されている。
12
https://www.mhlw.go.jp/content/11121000/001177939.pdf
13
https://www.mhlw.go.jp/content/11121000/001206148.pdf
21