よむ、つかう、まなぶ。
参考資料2 新型コロナワクチン「コミナティRTU筋注(1価:オミクロン株XBB.1.5 2価:起源株/オミクロン株BA.4-5)」(ファイザー株式会社)添付文書[862KB] (1 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/newpage_00106.html |
| 出典情報 | 厚生科学審議会・薬事審議会(合同開催) 予防接種・ワクチン分科会副反応検討部会(第102回 7/29)医薬品等安全対策部会安全対策調査会(令和6年度第4回 7/29)(合同開催)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
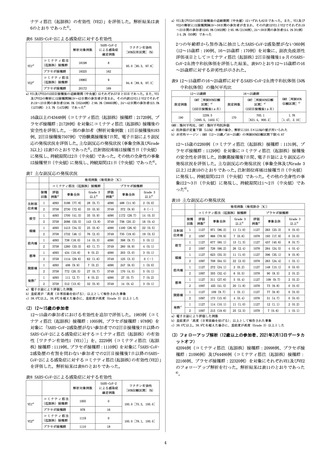
参考資料2
008
**2024年4月改訂(第8版、用法変更)
*2023年9月改訂
貯
法:-90~-60℃
** 有効期間:18ヵ月
*
日本標準商品分類番号
876313
ウイルスワクチン類
生物学的製剤基準
コロナウイルス(SARS-CoV-2)RNA ワクチン
承認番号
販売開始
劇薬、処方箋医薬品注)
30400AMX00016
2022 年 9 月
注)注意-医師等の処方箋により使用すること
8. 重要な基本的注意
** 8.1 本剤は「予防接種実施規則」及び「定期接種実施要領」に準拠し
2. 接種不適当者(予防接種を受けることが適当でない者)
2.1 明らかな発熱を呈している者
2.2 重篤な急性疾患にかかっていることが明らかな者
2.3 本剤の成分に対し重度の過敏症の既往歴のある者[8.4、9.1.6、
11.1.1参照]
2.4 上記に掲げる者のほか、予防接種を行うことが不適当な状態
にある者
て使用すること。
8.2 被接種者について、接種前に必ず問診、検温及び診察によって健
康状態を調べること。[9.1参照]
8.3 被接種者又はその保護者に、接種当日は過激な運動は避け、接種
部位を清潔に保ち、また、接種後の健康監視に留意し、局所の異常
反応や体調の変化、さらに高熱、痙攣等の異常な症状を呈した場合
には速やかに医師の診察を受けるよう事前に知らせること。
8.4 ショック、アナフィラキシーがあらわれることがあるため、接種
前に過敏症の既往歴等に関する問診を十分に行い、接種後一定時間、
被接種者の状態を観察することが望ましい。また、本剤接種後にシ
ョック、アナフィラキシーが認められた被接種者に対しては、以降
の本剤の接種を行わないこと。[2.3、9.1.6、11.1.1参照]
8.5 ワクチン接種直後又は接種後に注射による心因性反応を含む血管
迷走神経反射として失神があらわれることがある。失神による転倒
を避けるため、接種後一定時間は座らせるなどした上で被接種者の
状態を観察することが望ましい。
8.6 心筋炎、心膜炎があらわれることがあるため、被接種者又はその
保護者に対しては、心筋炎、心膜炎が疑われる症状(胸痛、動悸、
むくみ、呼吸困難、頻呼吸等)が認められた場合には、速やかに医
師の診察を受けるよう事前に知らせること。
[11.1.2、15.1.1、15.1.2
参照]
8.7 コロナウイルス(SARS-CoV-2)RNAワクチン接種後に、ギラン・バ
レー症候群が報告されている。被接種者又はその保護者に対しては、
ギラン・バレー症候群が疑われる症状(四肢遠位から始まる弛緩性
麻痺、腱反射の減弱ないし消失等)が認められた場合には直ちに医
師等に相談するよう、あらかじめ説明すること。
8.8 本剤と他のSARS-CoV-2に対するワクチンの互換性に関するデータ
はない。[7.3参照]
3. 製法の概要及び組成・性状
* 3.1 製法の概要
SARS-CoV-2のスパイクタンパク質のアミノ酸配列をコードするDNA
を鋳型として転写したRNAを精製し、脂質成分と混合する。
** 3.2 組成
*
販売名
コミナティRTU筋注
有効成分
ラクストジナメラン
容量
2.25mL
含量
0.225mg(RNA総量として)
添加剤
[
(4-ヒドロキシブチル)アザンジイル]ビス(ヘキサン-6,1-ジイル)ビス(2ヘキシルデカン酸エステル) 3.22mg
2-[(ポリエチレングリコール)-2000]-N,N-ジテトラデシルアセトアミド
0.4mg
1,2-ジステアロイル-sn-グリセロ-3-ホスホコリン 0.7mg
コレステロール 1.4mg
精製白糖 232mg
トロメタモール 0.45mg
トロメタモール塩酸塩 2.97mg
3.3 製剤の性状
販売名
コミナティRTU筋注
pH
6.9~7.9
浸透圧比
約1.2(生理食塩液に対する比)
性状
本品は白濁した液である。
4. 効能又は効果
SARS-CoV-2による感染症の予防
9. 特定の背景を有する者に関する注意
9.1 接種要注意者(接種の判断を行うに際し、注意を要する者)
被接種者が次のいずれかに該当すると認められる場合は、健康状態
及び体質を勘案し、診察及び接種適否の判断を慎重に行い、予防接
種の必要性、副反応、有用性について十分な説明を行い、同意を確
実に得た上で、注意して接種すること。
[8.2参照]
9.1.1 抗凝固療法を受けている者、血小板減少症又は凝固障害を有す
る者
本剤接種後に出血又は挫傷があらわれることがある。
9.1.2 過去に免疫不全の診断がなされている者及び近親者に先天性免
疫不全症の者がいる者
本剤に対する免疫応答が低下する可能性がある。
9.1.3 心臓血管系疾患、腎臓疾患、肝臓疾患、血液疾患、発育障害等
の基礎疾患を有する者
9.1.4 予防接種で接種後2日以内に発熱のみられた者及び全身性発疹
等のアレルギーを疑う症状を呈したことがある者
9.1.5 過去に痙攣の既往のある者
9.1.6 本剤の成分に対して、アレルギーを呈するおそれのある者
[2.3、8.4、11.1.1参照]
9.2 腎機能障害を有する者
接種要注意者である。
5. 効能又は効果に関連する注意
5.1 本剤の予防効果の持続期間は確立していない。
** 6. 用法及び用量
1回0.3mLを筋肉内に接種する。
** 7. 用法及び用量に関連する注意
7.1 接種対象者
12歳以上の者
7.2 接種時期
通常、
前回のSARS-CoV-2ワクチンの接種から少なくとも3ヵ月経過し
た後に接種することができる。
** 7.3 接種回数
過去にSARS-CoV-2ワクチンの接種歴のない者には、およそ4週間の間
隔をおいて2回目接種を行うことができる。[8.8参照]
** 7.4 同時接種
医師が必要と認めた場合には、他のワクチンと同時に接種すること
ができる。[14.2.2参照]
1
008
**2024年4月改訂(第8版、用法変更)
*2023年9月改訂
貯
法:-90~-60℃
** 有効期間:18ヵ月
*
日本標準商品分類番号
876313
ウイルスワクチン類
生物学的製剤基準
コロナウイルス(SARS-CoV-2)RNA ワクチン
承認番号
販売開始
劇薬、処方箋医薬品注)
30400AMX00016
2022 年 9 月
注)注意-医師等の処方箋により使用すること
8. 重要な基本的注意
** 8.1 本剤は「予防接種実施規則」及び「定期接種実施要領」に準拠し
2. 接種不適当者(予防接種を受けることが適当でない者)
2.1 明らかな発熱を呈している者
2.2 重篤な急性疾患にかかっていることが明らかな者
2.3 本剤の成分に対し重度の過敏症の既往歴のある者[8.4、9.1.6、
11.1.1参照]
2.4 上記に掲げる者のほか、予防接種を行うことが不適当な状態
にある者
て使用すること。
8.2 被接種者について、接種前に必ず問診、検温及び診察によって健
康状態を調べること。[9.1参照]
8.3 被接種者又はその保護者に、接種当日は過激な運動は避け、接種
部位を清潔に保ち、また、接種後の健康監視に留意し、局所の異常
反応や体調の変化、さらに高熱、痙攣等の異常な症状を呈した場合
には速やかに医師の診察を受けるよう事前に知らせること。
8.4 ショック、アナフィラキシーがあらわれることがあるため、接種
前に過敏症の既往歴等に関する問診を十分に行い、接種後一定時間、
被接種者の状態を観察することが望ましい。また、本剤接種後にシ
ョック、アナフィラキシーが認められた被接種者に対しては、以降
の本剤の接種を行わないこと。[2.3、9.1.6、11.1.1参照]
8.5 ワクチン接種直後又は接種後に注射による心因性反応を含む血管
迷走神経反射として失神があらわれることがある。失神による転倒
を避けるため、接種後一定時間は座らせるなどした上で被接種者の
状態を観察することが望ましい。
8.6 心筋炎、心膜炎があらわれることがあるため、被接種者又はその
保護者に対しては、心筋炎、心膜炎が疑われる症状(胸痛、動悸、
むくみ、呼吸困難、頻呼吸等)が認められた場合には、速やかに医
師の診察を受けるよう事前に知らせること。
[11.1.2、15.1.1、15.1.2
参照]
8.7 コロナウイルス(SARS-CoV-2)RNAワクチン接種後に、ギラン・バ
レー症候群が報告されている。被接種者又はその保護者に対しては、
ギラン・バレー症候群が疑われる症状(四肢遠位から始まる弛緩性
麻痺、腱反射の減弱ないし消失等)が認められた場合には直ちに医
師等に相談するよう、あらかじめ説明すること。
8.8 本剤と他のSARS-CoV-2に対するワクチンの互換性に関するデータ
はない。[7.3参照]
3. 製法の概要及び組成・性状
* 3.1 製法の概要
SARS-CoV-2のスパイクタンパク質のアミノ酸配列をコードするDNA
を鋳型として転写したRNAを精製し、脂質成分と混合する。
** 3.2 組成
*
販売名
コミナティRTU筋注
有効成分
ラクストジナメラン
容量
2.25mL
含量
0.225mg(RNA総量として)
添加剤
[
(4-ヒドロキシブチル)アザンジイル]ビス(ヘキサン-6,1-ジイル)ビス(2ヘキシルデカン酸エステル) 3.22mg
2-[(ポリエチレングリコール)-2000]-N,N-ジテトラデシルアセトアミド
0.4mg
1,2-ジステアロイル-sn-グリセロ-3-ホスホコリン 0.7mg
コレステロール 1.4mg
精製白糖 232mg
トロメタモール 0.45mg
トロメタモール塩酸塩 2.97mg
3.3 製剤の性状
販売名
コミナティRTU筋注
pH
6.9~7.9
浸透圧比
約1.2(生理食塩液に対する比)
性状
本品は白濁した液である。
4. 効能又は効果
SARS-CoV-2による感染症の予防
9. 特定の背景を有する者に関する注意
9.1 接種要注意者(接種の判断を行うに際し、注意を要する者)
被接種者が次のいずれかに該当すると認められる場合は、健康状態
及び体質を勘案し、診察及び接種適否の判断を慎重に行い、予防接
種の必要性、副反応、有用性について十分な説明を行い、同意を確
実に得た上で、注意して接種すること。
[8.2参照]
9.1.1 抗凝固療法を受けている者、血小板減少症又は凝固障害を有す
る者
本剤接種後に出血又は挫傷があらわれることがある。
9.1.2 過去に免疫不全の診断がなされている者及び近親者に先天性免
疫不全症の者がいる者
本剤に対する免疫応答が低下する可能性がある。
9.1.3 心臓血管系疾患、腎臓疾患、肝臓疾患、血液疾患、発育障害等
の基礎疾患を有する者
9.1.4 予防接種で接種後2日以内に発熱のみられた者及び全身性発疹
等のアレルギーを疑う症状を呈したことがある者
9.1.5 過去に痙攣の既往のある者
9.1.6 本剤の成分に対して、アレルギーを呈するおそれのある者
[2.3、8.4、11.1.1参照]
9.2 腎機能障害を有する者
接種要注意者である。
5. 効能又は効果に関連する注意
5.1 本剤の予防効果の持続期間は確立していない。
** 6. 用法及び用量
1回0.3mLを筋肉内に接種する。
** 7. 用法及び用量に関連する注意
7.1 接種対象者
12歳以上の者
7.2 接種時期
通常、
前回のSARS-CoV-2ワクチンの接種から少なくとも3ヵ月経過し
た後に接種することができる。
** 7.3 接種回数
過去にSARS-CoV-2ワクチンの接種歴のない者には、およそ4週間の間
隔をおいて2回目接種を行うことができる。[8.8参照]
** 7.4 同時接種
医師が必要と認めた場合には、他のワクチンと同時に接種すること
ができる。[14.2.2参照]
1