よむ、つかう、まなぶ。
資料1-6:認定臨床研究審査委員会について (2 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_42147.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第35回 8/8)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
認定臨床研究審査委員会(CRB)の課題
現在の状況
○
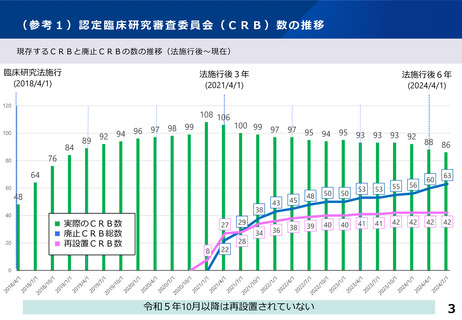
CRBの数について
• CRB廃止後に再設置するケースがある
• 廃止時手続き等の相談の際に、地方厚生局から再設置は控えるよう説明しているが、実効性に限界
がある
• 令和6年は多くのCRBが法施行後2度目の更新時期に当たるため、同様の相談が増えると予想
○
CRBの審査の質について
• 審査の質の評価について模擬審査事業を実施してきたが、評価手法の検討が必要であり、被評価C
RBへの十分なフィードバックとフォローアップができていない
• 令和4年度から臨床研究中核病院でピアレビューを実施しており、今年度から他CRBへも展開
• 審査の内容が公表されていないため、他機関のCRBの審査の実態を知ることができない
今後の検討事項
○
CRBの数について
• 臨床研究法施行規則で、CRBを再設置する場合に求める要件(廃止後一定期間は認定しない、改
善計画の提出等)を追加するべきか。
○
CRBの審査の質について
• 審査の質を定期的にモニタリングし、恒常的に質を維持するため、実際の審議内容を議事録等を用
いて定期的に評価を受けることを更新の要件とするか。
2
現在の状況
○
CRBの数について
• CRB廃止後に再設置するケースがある
• 廃止時手続き等の相談の際に、地方厚生局から再設置は控えるよう説明しているが、実効性に限界
がある
• 令和6年は多くのCRBが法施行後2度目の更新時期に当たるため、同様の相談が増えると予想
○
CRBの審査の質について
• 審査の質の評価について模擬審査事業を実施してきたが、評価手法の検討が必要であり、被評価C
RBへの十分なフィードバックとフォローアップができていない
• 令和4年度から臨床研究中核病院でピアレビューを実施しており、今年度から他CRBへも展開
• 審査の内容が公表されていないため、他機関のCRBの審査の実態を知ることができない
今後の検討事項
○
CRBの数について
• 臨床研究法施行規則で、CRBを再設置する場合に求める要件(廃止後一定期間は認定しない、改
善計画の提出等)を追加するべきか。
○
CRBの審査の質について
• 審査の質を定期的にモニタリングし、恒常的に質を維持するため、実際の審議内容を議事録等を用
いて定期的に評価を受けることを更新の要件とするか。
2