よむ、つかう、まなぶ。
【資料3】医薬局からの定期報告[214KB] (1 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_43642.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第17回 9/20)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
第 17 回
医薬品等行政評価・監視委員会
令和6年9月 20 日
資料3
医薬局からの定期報告
1
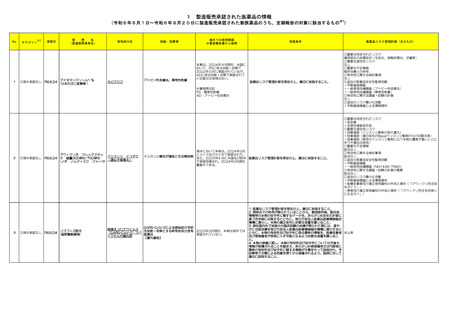
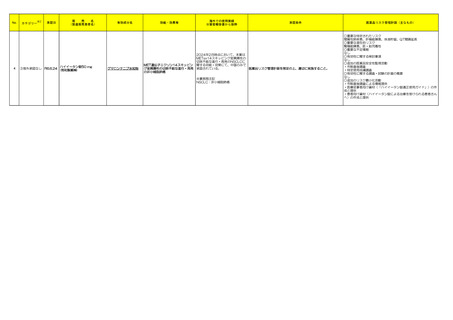
製造販売承認された医薬品の情報
2ページ
※1
本表は「「医薬局からの定期報告」の報告対象等について」(令和3年7月 19 日 医薬品
等行政評価・監視委員会決定、令和6年4月1日最終改訂)に基づき、新有効成分を含有する
医薬品のうち、以下のいずれかに該当するものを抜粋したもの。
①先駆け審査指定制度の対象品目
②条件付き早期承認制度の対象品目
③海外で承認されていない医薬品
④特例承認の対象品目
⑤緊急承認の対象品目
(海外での承認の有無及び使用実績は、審査報告書の記載により判断しています。)
※2
「カテゴリー」の語句は以下を指す。
①先駆(先駆け):先駆的医薬品指定制度(先駆け審査指定制度)の対象品目
②条件付き:条件付き早期承認制度の対象品目
③海外承認なし:海外で承認されていない医薬品
④特例承認:特例承認の対象品目
⑤緊急承認:緊急承認の対象品目
※ 「国内における市販後の安全対策の措置状況」及び「外国での新たな措置の報告状況」
については、対象の情報を取りまとめた上で、次回監視委員会にて報告予定。
医薬品等行政評価・監視委員会
令和6年9月 20 日
資料3
医薬局からの定期報告
1
製造販売承認された医薬品の情報
2ページ
※1
本表は「「医薬局からの定期報告」の報告対象等について」(令和3年7月 19 日 医薬品
等行政評価・監視委員会決定、令和6年4月1日最終改訂)に基づき、新有効成分を含有する
医薬品のうち、以下のいずれかに該当するものを抜粋したもの。
①先駆け審査指定制度の対象品目
②条件付き早期承認制度の対象品目
③海外で承認されていない医薬品
④特例承認の対象品目
⑤緊急承認の対象品目
(海外での承認の有無及び使用実績は、審査報告書の記載により判断しています。)
※2
「カテゴリー」の語句は以下を指す。
①先駆(先駆け):先駆的医薬品指定制度(先駆け審査指定制度)の対象品目
②条件付き:条件付き早期承認制度の対象品目
③海外承認なし:海外で承認されていない医薬品
④特例承認:特例承認の対象品目
⑤緊急承認:緊急承認の対象品目
※ 「国内における市販後の安全対策の措置状況」及び「外国での新たな措置の報告状況」
については、対象の情報を取りまとめた上で、次回監視委員会にて報告予定。