よむ、つかう、まなぶ。
【資料3】医薬局からの定期報告[214KB] (2 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_43642.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第17回 9/20)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
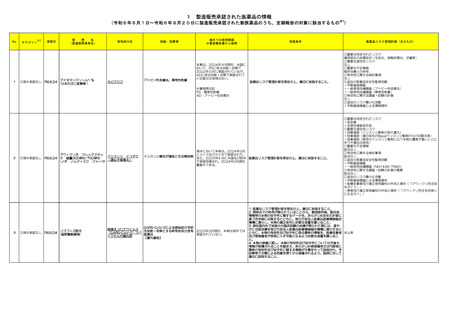
1 製造販売承認された医薬品の情報
(令和6年6月1日~令和6年8月20日に製造販売承認された新医薬品のうち、定期報告の対象に該当するもの※1)
No.
1
※2
カテゴリー
承認日
③海外承認なし R6.6.24
販
売
名
(製造販売業者名)
ブイタマークリーム1 %
(日本たばこ産業㈱ )
有効成分名
タピナロフ
効能・効果等
アトピー性皮膚炎、尋常性乾癬
海外での使用実績
※審査報告書から抜粋
承認条件
本薬は、2024年4月現在、米国に
おいて、PSに係る効能・効果で
2022年5月に承認されているが、
ADに係る効能・効果で承認されて
いる国又は地域はない。
医薬品リスク管理計画を策定の上、適切に実施すること。
※事務局注記
PS:尋常性乾癬
AD:アトピー性皮膚炎
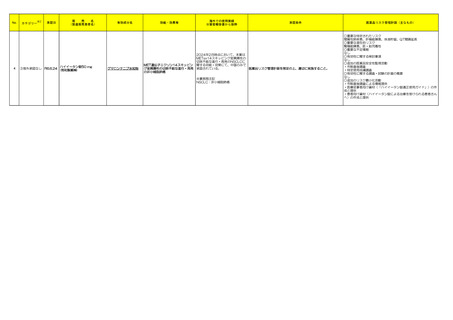
2
3
アウィクリ注 フレックスタッ
インスリン イコデク
③海外承認なし R6.6.24 チ 総量300単位/700単位
(遺伝子組換え)
(ノボ ノルディスク ファーマ)
③海外承認なし R6.6.24
コブゴーズ筋注
(塩野義製薬㈱)
インスリン療法が適応となる糖尿病
海外において本剤は、2024年3月
にスイス及びカナダで承認された。
また、2023年4 月に米国及び欧州 医薬品リスク管理計画を策定の上、適切に実施すること。
で承認申請され、2024年3月現在
審査中である。
SARS-CoV-2による感染症の予防
組換えコロナウイルス
を効能・効果とする新有効成分含有 2023年3月現在、本剤は海外では
(SARS-CoV-2)スパ
医薬品
承認されていない。
イクたん白質抗原
【優先審査】
医薬品リスク管理計画(主なもの)
○重要な特定されたリスク
適用部位の皮膚症状(毛包炎,接触皮膚炎,ざ瘡等)
○重要な潜在的リスク
なし
○重要な不足情報
既存治療との併用
○有効性に関する検討事項
なし
○追加の医薬品安全性監視活動
・市販直後調査
・一般使用成績調査(アトピー性皮膚炎)
・一般使用成績調査(尋常性乾癬)
○有効性に関する調査・試験の計画
なし
○追加のリスク最小化活動
・市販直後調査による情報提供
○重要な特定されたリスク
・低血糖
・全身性過敏症反応
○重要な潜在的リスク
・投薬過誤(インスリン製剤の取り違え)
・投薬過誤(連日投与のBasalインスリン製剤からの切替え時)
・投薬過誤(既存のインスリン製剤に比べ本剤の濃度が高いことに
伴う不適切な使用)
○重要な不足情報
該当なし
○有効性に関する検討事項
該当なし
○追加の医薬品安全性監視活動
・市販直後調査
・一般使用成績調査(NN1436-7680)
○有効性に関する調査・試験の計画の概要
該当なし
○追加のリスク最小化活動
・市販直後調査による情報提供
・医療従事者向け適正使用資材の作成と提供(「アウィクリ®注投
与ガイド」)
・患者向け適正使用資材の作成と提供(「アウィクリ®注をお使い
になる方へ」)
1. 医薬品リスク管理計画を策定の上、適切に実施すること。
2. 現時点での知見が限られていることから、製造販売後、副反応
情報等の本剤の安全性に関するデータを、あらかじめ定めた計画に
基づき早期に収集するとともに、独立行政法人医薬品医療機器総合
機構に提出し、本剤の適正使用に必要な措置を講じること。
3. 現在国内外で実施中の臨床試験の成績が得られた際には、速や
かに当該成績を独立行政法人医薬品医療機器総合機構に提出すると
ともに、本剤の有効性及び安全性に係る最新の情報を、医療従事者 未公表
及び被接種者が容易に入手可能となるよう必要な措置を講じるこ
と。
4. 本剤の接種に際し、本剤の有効性及び安全性については今後も
情報が集積されることを踏まえ、あらかじめ被接種者又は代諾者に
最新の有効性及び安全性に関する情報が文書をもって説明され、予
診票等で文書による同意を得てから接種されるよう、医師に対して
適切に説明すること。
(令和6年6月1日~令和6年8月20日に製造販売承認された新医薬品のうち、定期報告の対象に該当するもの※1)
No.
1
※2
カテゴリー
承認日
③海外承認なし R6.6.24
販
売
名
(製造販売業者名)
ブイタマークリーム1 %
(日本たばこ産業㈱ )
有効成分名
タピナロフ
効能・効果等
アトピー性皮膚炎、尋常性乾癬
海外での使用実績
※審査報告書から抜粋
承認条件
本薬は、2024年4月現在、米国に
おいて、PSに係る効能・効果で
2022年5月に承認されているが、
ADに係る効能・効果で承認されて
いる国又は地域はない。
医薬品リスク管理計画を策定の上、適切に実施すること。
※事務局注記
PS:尋常性乾癬
AD:アトピー性皮膚炎
2
3
アウィクリ注 フレックスタッ
インスリン イコデク
③海外承認なし R6.6.24 チ 総量300単位/700単位
(遺伝子組換え)
(ノボ ノルディスク ファーマ)
③海外承認なし R6.6.24
コブゴーズ筋注
(塩野義製薬㈱)
インスリン療法が適応となる糖尿病
海外において本剤は、2024年3月
にスイス及びカナダで承認された。
また、2023年4 月に米国及び欧州 医薬品リスク管理計画を策定の上、適切に実施すること。
で承認申請され、2024年3月現在
審査中である。
SARS-CoV-2による感染症の予防
組換えコロナウイルス
を効能・効果とする新有効成分含有 2023年3月現在、本剤は海外では
(SARS-CoV-2)スパ
医薬品
承認されていない。
イクたん白質抗原
【優先審査】
医薬品リスク管理計画(主なもの)
○重要な特定されたリスク
適用部位の皮膚症状(毛包炎,接触皮膚炎,ざ瘡等)
○重要な潜在的リスク
なし
○重要な不足情報
既存治療との併用
○有効性に関する検討事項
なし
○追加の医薬品安全性監視活動
・市販直後調査
・一般使用成績調査(アトピー性皮膚炎)
・一般使用成績調査(尋常性乾癬)
○有効性に関する調査・試験の計画
なし
○追加のリスク最小化活動
・市販直後調査による情報提供
○重要な特定されたリスク
・低血糖
・全身性過敏症反応
○重要な潜在的リスク
・投薬過誤(インスリン製剤の取り違え)
・投薬過誤(連日投与のBasalインスリン製剤からの切替え時)
・投薬過誤(既存のインスリン製剤に比べ本剤の濃度が高いことに
伴う不適切な使用)
○重要な不足情報
該当なし
○有効性に関する検討事項
該当なし
○追加の医薬品安全性監視活動
・市販直後調査
・一般使用成績調査(NN1436-7680)
○有効性に関する調査・試験の計画の概要
該当なし
○追加のリスク最小化活動
・市販直後調査による情報提供
・医療従事者向け適正使用資材の作成と提供(「アウィクリ®注投
与ガイド」)
・患者向け適正使用資材の作成と提供(「アウィクリ®注をお使い
になる方へ」)
1. 医薬品リスク管理計画を策定の上、適切に実施すること。
2. 現時点での知見が限られていることから、製造販売後、副反応
情報等の本剤の安全性に関するデータを、あらかじめ定めた計画に
基づき早期に収集するとともに、独立行政法人医薬品医療機器総合
機構に提出し、本剤の適正使用に必要な措置を講じること。
3. 現在国内外で実施中の臨床試験の成績が得られた際には、速や
かに当該成績を独立行政法人医薬品医療機器総合機構に提出すると
ともに、本剤の有効性及び安全性に係る最新の情報を、医療従事者 未公表
及び被接種者が容易に入手可能となるよう必要な措置を講じるこ
と。
4. 本剤の接種に際し、本剤の有効性及び安全性については今後も
情報が集積されることを踏まえ、あらかじめ被接種者又は代諾者に
最新の有効性及び安全性に関する情報が文書をもって説明され、予
診票等で文書による同意を得てから接種されるよう、医師に対して
適切に説明すること。