よむ、つかう、まなぶ。
【資料5】全規格揃えについて (3 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_44453.html |
| 出典情報 | 医療用医薬品の安定確保策に関する関係者会議(第17回 10/21)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
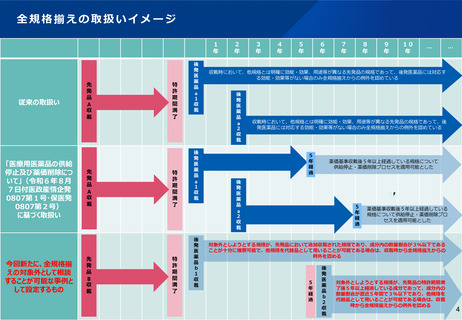
後発医薬品の全規格揃えの対象外判断に係る運用基準(案)
⚫ 後発医薬品の規格については、原則、先発品が有する規格を全て揃えて保険収載することを求めている。ただし、医療上必ずしも必要
でないと考えられる規格については、厚生労働省に個別相談の上、全規格揃えの対象外とすることも可能である。
⚫ 一方、全規格揃えの対象外とすることが可能かについては、現状、関連文書において下表の黒字部の記載があるのみであり、対象事例
が具体化・明確化されていないとの指摘がある。ついては、必要な規格を揃えつつ、規格揃えの原則の合理化を図るため、後発医薬品
の全規格揃えの対象外とすることを相談できる事例として、下表赤字部の事例を設定し、周知することとしてはどうか。
⚫ なお、企業が厚生労働省に相談するにあたっては、現状も全規格揃えの対象外としても医療上支障が生じないことの根拠資料を提出す
ることを求めているが、今回新たに設定する事例に係る根拠資料(対象外とすることを希望する規格に係る成分内の数量割合等)につ
いても企業に提出することを求めることとする。
薬価基準収載時
薬価削除時
○現在関連文書等において、全規格揃えの対象外として相談することが可
能な事例として記載されているもの
・他規格とは明確に効能・効果、用途等が異なる先発品の規格であって、
後発医薬品には対応する効能・効果等がない場合
○現在関連文書等において、全規格揃えの対象外として相談することが可
能な事例として記載されているもの
・当該後発医薬品が薬価基準収載後5年以上経過している場合
○今回新たに、全規格揃えの対象外として相談することが可能な事例とし
て設定するもの
①対象外としようとする規格が、先発品において追加収載された規格で
あり、成分内の数量割合が3%以下※であることが十分に推察可能で、
他規格を代替品として用いることが可能である場合
②対象外としようとする規格が、先発品の特許期間満了後5年以上経過
している成分であって、成分内の数量割合が直近5年間で3%以下※
であり、他規格を代替品として用いることが可能である場合
※ただし、効能・効果等が一部の規格のみに認められている場合は、当該効能・効果等
が認められた規格内での数量割合で判断(例 10mg錠:疾患A用、20mg錠:疾患A
用及び疾患B用、50mg錠:疾患B用の場合に、10mg錠を対象外とすることを希望す
る場合は、10mg錠の数量が、10mg錠+20mg錠の数量の3%以下であることを確認)
また、3%については、先発品の特許期間満了後5年以上経過している場合は、直
近5年の平均で判断する等、適切な期間を設定した上で、当該期間内の平均で判断。
3
⚫ 後発医薬品の規格については、原則、先発品が有する規格を全て揃えて保険収載することを求めている。ただし、医療上必ずしも必要
でないと考えられる規格については、厚生労働省に個別相談の上、全規格揃えの対象外とすることも可能である。
⚫ 一方、全規格揃えの対象外とすることが可能かについては、現状、関連文書において下表の黒字部の記載があるのみであり、対象事例
が具体化・明確化されていないとの指摘がある。ついては、必要な規格を揃えつつ、規格揃えの原則の合理化を図るため、後発医薬品
の全規格揃えの対象外とすることを相談できる事例として、下表赤字部の事例を設定し、周知することとしてはどうか。
⚫ なお、企業が厚生労働省に相談するにあたっては、現状も全規格揃えの対象外としても医療上支障が生じないことの根拠資料を提出す
ることを求めているが、今回新たに設定する事例に係る根拠資料(対象外とすることを希望する規格に係る成分内の数量割合等)につ
いても企業に提出することを求めることとする。
薬価基準収載時
薬価削除時
○現在関連文書等において、全規格揃えの対象外として相談することが可
能な事例として記載されているもの
・他規格とは明確に効能・効果、用途等が異なる先発品の規格であって、
後発医薬品には対応する効能・効果等がない場合
○現在関連文書等において、全規格揃えの対象外として相談することが可
能な事例として記載されているもの
・当該後発医薬品が薬価基準収載後5年以上経過している場合
○今回新たに、全規格揃えの対象外として相談することが可能な事例とし
て設定するもの
①対象外としようとする規格が、先発品において追加収載された規格で
あり、成分内の数量割合が3%以下※であることが十分に推察可能で、
他規格を代替品として用いることが可能である場合
②対象外としようとする規格が、先発品の特許期間満了後5年以上経過
している成分であって、成分内の数量割合が直近5年間で3%以下※
であり、他規格を代替品として用いることが可能である場合
※ただし、効能・効果等が一部の規格のみに認められている場合は、当該効能・効果等
が認められた規格内での数量割合で判断(例 10mg錠:疾患A用、20mg錠:疾患A
用及び疾患B用、50mg錠:疾患B用の場合に、10mg錠を対象外とすることを希望す
る場合は、10mg錠の数量が、10mg錠+20mg錠の数量の3%以下であることを確認)
また、3%については、先発品の特許期間満了後5年以上経過している場合は、直
近5年の平均で判断する等、適切な期間を設定した上で、当該期間内の平均で判断。
3