よむ、つかう、まなぶ。
資料2-4 要指導医薬品のリスク評価について[587KB] (1 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_44308.html |
| 出典情報 | 薬事審議会 医薬品等安全対策部会(令和6年度第2回 10/24)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
令和6年 10 月 24 日
令和6年度第2回医薬品等安全対策部会
資料2-4
要指導医薬品のリスク評価について
○
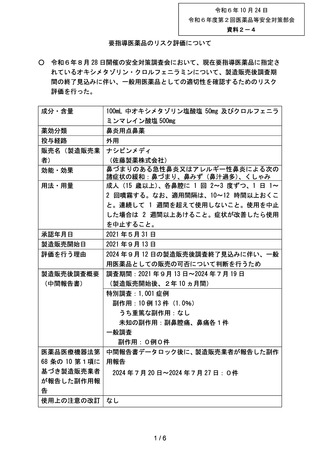
令和6年8月 28 日開催の安全対策調査会において、現在要指導医薬品に指定さ
れているオキシメタゾリン・クロルフェニラミンについて、製造販売後調査期
間の終了見込みに伴い、一般用医薬品としての適切性を確認するためのリスク
評価を行った。
成分・含量
100mL 中オキシメタゾリン塩酸塩 50mg 及びクロルフェニラ
ミンマレイン酸塩 500mg
薬効分類
鼻炎用点鼻薬
投与経路
外用
販売名(製造販売業 ナシビンメディ
者)
(佐藤製薬株式会社)
鼻づまりのある急性鼻炎又はアレルギー性鼻炎による次の
効能・効果
諸症状の緩和:鼻づまり、鼻みず(鼻汁過多)、くしゃみ
用法・用量
成人(15 歳以上)、各鼻腔に 1 回 2~3 度ずつ、1 日 1~
2 回噴霧する。なお、適用間隔は、10~12 時間以上おくこ
と。連続して 1 週間を超えて使用しないこと。使用を中止
した場合は 2 週間以上あけること。症状が改善したら使用
を中止すること。
承認年月日
2021 年5月 31 日
製造販売開始日
2021 年9月 13 日
評価を行う理由
2024 年9月 12 日の製造販売後調査終了見込みに伴い、一般
用医薬品としての販売の可否について判断を行うため
製造販売後調査概要
(中間報告書)
調査期間:2021 年9月 13 日~2024 年7月 19 日
(製造販売開始後、2年 10 ヵ月間)
特別調査:1,001 症例
副作用:10 例 13 件(1.0%)
うち重篤な副作用:なし
未知の副作用:副鼻腔痛、鼻痛各1件
一般調査
副作用:0例0件
医薬品医療機器法第 中間報告書データロック後に、製造販売業者が報告した副作
68 条の 10 第1項に 用報告
基づき製造販売業者
2024 年7月 20 日~2024 年7月 27 日:0件
が報告した副作用報
告
使用上の注意の改訂 なし
1/6
令和6年度第2回医薬品等安全対策部会
資料2-4
要指導医薬品のリスク評価について
○
令和6年8月 28 日開催の安全対策調査会において、現在要指導医薬品に指定さ
れているオキシメタゾリン・クロルフェニラミンについて、製造販売後調査期
間の終了見込みに伴い、一般用医薬品としての適切性を確認するためのリスク
評価を行った。
成分・含量
100mL 中オキシメタゾリン塩酸塩 50mg 及びクロルフェニラ
ミンマレイン酸塩 500mg
薬効分類
鼻炎用点鼻薬
投与経路
外用
販売名(製造販売業 ナシビンメディ
者)
(佐藤製薬株式会社)
鼻づまりのある急性鼻炎又はアレルギー性鼻炎による次の
効能・効果
諸症状の緩和:鼻づまり、鼻みず(鼻汁過多)、くしゃみ
用法・用量
成人(15 歳以上)、各鼻腔に 1 回 2~3 度ずつ、1 日 1~
2 回噴霧する。なお、適用間隔は、10~12 時間以上おくこ
と。連続して 1 週間を超えて使用しないこと。使用を中止
した場合は 2 週間以上あけること。症状が改善したら使用
を中止すること。
承認年月日
2021 年5月 31 日
製造販売開始日
2021 年9月 13 日
評価を行う理由
2024 年9月 12 日の製造販売後調査終了見込みに伴い、一般
用医薬品としての販売の可否について判断を行うため
製造販売後調査概要
(中間報告書)
調査期間:2021 年9月 13 日~2024 年7月 19 日
(製造販売開始後、2年 10 ヵ月間)
特別調査:1,001 症例
副作用:10 例 13 件(1.0%)
うち重篤な副作用:なし
未知の副作用:副鼻腔痛、鼻痛各1件
一般調査
副作用:0例0件
医薬品医療機器法第 中間報告書データロック後に、製造販売業者が報告した副作
68 条の 10 第1項に 用報告
基づき製造販売業者
2024 年7月 20 日~2024 年7月 27 日:0件
が報告した副作用報
告
使用上の注意の改訂 なし
1/6