よむ、つかう、まなぶ。
議題1 別紙1新規技術(1月受理分)の先進医療A又は先進医療Bへの振り分けについて(案) (3 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_48654.html |
| 出典情報 | 先進医療会議(第139回 1/9)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
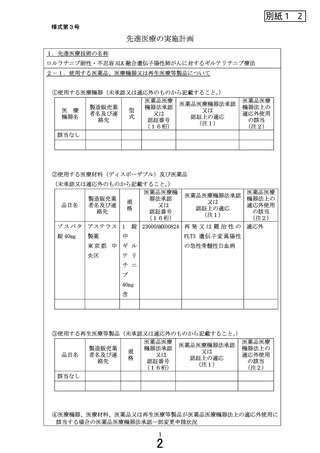
医療機器名又は品目名
医薬品医療機器法承認一部変更申請状況
⑤医療機器、医療材料、医薬品又は再生医療等製品が医薬品医療機器法上の未承認又は適
応外使用に該当する場合の使用方法等
・ギルテリチニブ初回投与は最後の抗悪性腫瘍薬投与から少なくとも 7 日間経過し
ていることを確認して行う。
・ギルテリチニブを、1日 1 回、1回 120mg を経口投与し、病勢進行(臨床的増悪を
含む)を認めるかもしくは忍容できない疾病等が出現するまで継続する。
・本剤は連日投与であるが 28 日間(4 週間)の投与をもって1コースとみなす。
・なお、1 コースの投与により明らかな効果を認めずかつすべての疾病等がグレード
1以下である場合は、患者の状態を考慮したうえで有益性が期待される場合のみ 1 日
1 回 200mg に増量することを検討できる
⑥未承認又は適応外の場合は、□にレと記載する。
☑
当該医薬品・医療機器・再生医療等製品について、薬事承認の申請時及び
取得時において、申請企業から情報提供がなされることとなっている。
注1)医薬品医療機器法承認又は認証上の使用目的、効能及び効果を記入すること。
注2)医薬品医療機器法において適応外使用に該当する場合は「適応外」
、医薬品医療機器法で承認された
適応の範囲内の使用の場合は「適応内」と記載すること。
2-2.海外での承認に関する情報
米国での薬事承認の状況
FLT3 遺伝子変異陽性、再発または難治性の急性骨髄性白血病に対する治療として 2018 年
に FDA で承認されており、公的保険の対象である。ALK 陽性肺がんについては承認を受け
ていない。
欧州での薬事承認の状況
FLT3 遺伝子変異陽性、再発または難治性の急性骨髄性白血病に対する治療として 2019 年
に EMA で承認されており、公的保険の対象である。ALK 陽性肺がんについては承認を受け
ていない。
2
3
医薬品医療機器法承認一部変更申請状況
⑤医療機器、医療材料、医薬品又は再生医療等製品が医薬品医療機器法上の未承認又は適
応外使用に該当する場合の使用方法等
・ギルテリチニブ初回投与は最後の抗悪性腫瘍薬投与から少なくとも 7 日間経過し
ていることを確認して行う。
・ギルテリチニブを、1日 1 回、1回 120mg を経口投与し、病勢進行(臨床的増悪を
含む)を認めるかもしくは忍容できない疾病等が出現するまで継続する。
・本剤は連日投与であるが 28 日間(4 週間)の投与をもって1コースとみなす。
・なお、1 コースの投与により明らかな効果を認めずかつすべての疾病等がグレード
1以下である場合は、患者の状態を考慮したうえで有益性が期待される場合のみ 1 日
1 回 200mg に増量することを検討できる
⑥未承認又は適応外の場合は、□にレと記載する。
☑
当該医薬品・医療機器・再生医療等製品について、薬事承認の申請時及び
取得時において、申請企業から情報提供がなされることとなっている。
注1)医薬品医療機器法承認又は認証上の使用目的、効能及び効果を記入すること。
注2)医薬品医療機器法において適応外使用に該当する場合は「適応外」
、医薬品医療機器法で承認された
適応の範囲内の使用の場合は「適応内」と記載すること。
2-2.海外での承認に関する情報
米国での薬事承認の状況
FLT3 遺伝子変異陽性、再発または難治性の急性骨髄性白血病に対する治療として 2018 年
に FDA で承認されており、公的保険の対象である。ALK 陽性肺がんについては承認を受け
ていない。
欧州での薬事承認の状況
FLT3 遺伝子変異陽性、再発または難治性の急性骨髄性白血病に対する治療として 2019 年
に EMA で承認されており、公的保険の対象である。ALK 陽性肺がんについては承認を受け
ていない。
2
3