よむ、つかう、まなぶ。
資料3-1 先進医療Bの継続の可否に係る審議結果の報告について(告示番号47)【報告事項】 (2 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_25067.html |
| 出典情報 | 先進医療会議 先進医療技術審査部会(第132回 4/18)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
22900AMX00865
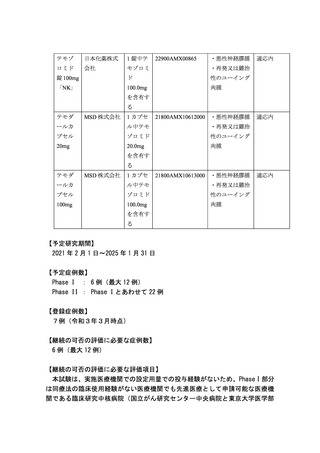
テモゾ
日本化薬株式
1 錠中テ
ロミド
会社
モゾロミ
・再発又は難治
錠 100mg
ド
性のユーイング
「NK」
100.0mg
肉腫
・悪性神経膠腫
適応内
を含有す
る
1 カプセ
21800AMX10612000 ・悪性神経膠腫
ールカ
ル中テモ
・再発又は難治
プセル
ゾロミド
性のユーイング
20mg
20.0mg
肉腫
テモダ
MSD 株式会社
適応内
を含有す
る
1 カプセ
21800AMX10613000 ・悪性神経膠腫
ールカ
ル中テモ
・再発又は難治
プセル
ゾロミド
性のユーイング
100mg
100.0mg
肉腫
テモダ
MSD 株式会社
適応内
を含有す
る
【予定研究期間】
2021 年 2 月 1 日~2025 年 1 月 31 日
【予定症例数】
Phase I : 6 例(最大 12 例)
Phase II : Phase I とあわせて 22 例
【登録症例数】
7例(令和3年3月時点)
【継続の可否の評価に必要な症例数】
6 例(最大 12 例)
【継続の可否の評価に必要な評価項目】
本試験は、実施医療機関での設定用量での投与経験がないため、Phase I 部分
は同療法の臨床使用経験がない医療機関でも先進医療として申請可能な医療機
関である臨床研究中核病院(国立がん研究センター中央病院と東京大学医学部
テモゾ
日本化薬株式
1 錠中テ
ロミド
会社
モゾロミ
・再発又は難治
錠 100mg
ド
性のユーイング
「NK」
100.0mg
肉腫
・悪性神経膠腫
適応内
を含有す
る
1 カプセ
21800AMX10612000 ・悪性神経膠腫
ールカ
ル中テモ
・再発又は難治
プセル
ゾロミド
性のユーイング
20mg
20.0mg
肉腫
テモダ
MSD 株式会社
適応内
を含有す
る
1 カプセ
21800AMX10613000 ・悪性神経膠腫
ールカ
ル中テモ
・再発又は難治
プセル
ゾロミド
性のユーイング
100mg
100.0mg
肉腫
テモダ
MSD 株式会社
適応内
を含有す
る
【予定研究期間】
2021 年 2 月 1 日~2025 年 1 月 31 日
【予定症例数】
Phase I : 6 例(最大 12 例)
Phase II : Phase I とあわせて 22 例
【登録症例数】
7例(令和3年3月時点)
【継続の可否の評価に必要な症例数】
6 例(最大 12 例)
【継続の可否の評価に必要な評価項目】
本試験は、実施医療機関での設定用量での投与経験がないため、Phase I 部分
は同療法の臨床使用経験がない医療機関でも先進医療として申請可能な医療機
関である臨床研究中核病院(国立がん研究センター中央病院と東京大学医学部