よむ、つかう、まなぶ。
資料3-1 先進医療Bの継続の可否に係る審議結果の報告について(告示番号47)【報告事項】 (3 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_25067.html |
| 出典情報 | 先進医療会議 先進医療技術審査部会(第132回 4/18)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
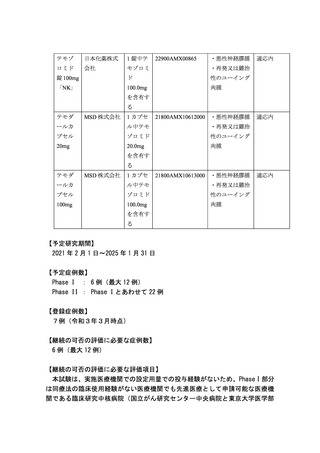
附属病院の 2 施設)で行う。Phase I は 2 つの用量レベルを設定し、各レベル 3
例~6 例、計 6~12 例で評価する。Phase I 終了時に効果・安全性評価委員会に
よる評価を経て先進医療技術審査部会への報告を行い、本試験の継続に関して
承認を得た後、Phase II 部分から他の実施予定医療機関に施設を拡大する。な
お、Phase I 部分完了に至らない時期においても各レベルで重篤な有害事象が出
現する等安全性上の懸念がある場合は、その時点で効果・安全性評価委員会を
開催し、必要に応じて先進医療技術審査部会へも報告を行う。
【継続の可否に係る独立した委員会の審議結果】
研究代表者及び研究事務局の報告によると、3 例について最初の用量レベル 1
(メトホルミン 1500mg+テモゾロミド)の投与が行われ、用量制限毒性(DLT)に
相当する有害事象はなく、用量レベル 2(メトホルミン 2250mg+テモゾロミド)
に進むこととなった。用量レベル 2 の第一例目は、grade 2 の食欲不振の報告が
あったが、試験実施計画書「2.4.2.2.DLT の定義」に規定している手順に従い、
効果安全性評価委員 2 名に諮ったところ、テモゾロミドとの併用前のメトホル
ミン単独投与時の食欲不振の報告であるという理由で、 DLT 評価対象例としな
いこととなった。その他の用量レベル 2 に登録された 3 例において事前投与期
間を含むメトホルミン併用テモゾロミド維持治療 2 コース目開始までの観察が
終了し、データが収集・確認された。
効果・安全性評価委員会での審議の結果、「用量制限毒性(DLT)もしくは用
量制限毒性(DLT)に類する有害事象の発現はなく、用量レベル 2 で PhaseII へ
移行する」と判断された。
その結果を受けて、先進医療技術審査部会構成員(主担当、副担当(生物統
計担当))及び技術専門委員によってご審議(メール稟議)いただいた結果、
先進医療継続可との評価を得たため、新規症例登録が再開された(※)。
(※)第 59 回先進医療技術審査部会にて、評価に必要な数症例の試験結果および、その結
果について独立データモニタリング委員会等で審議された結果を、評価担当構成員(申請
時の主担当、副担当(生物統計担当))の先生方にご確認いただき、先進医療継続の可否
についてご評価(メール稟議)いただくこと、継続可となれば速やかに試験を再開してよ
いこととし、後日先進医療技術審査部会に報告することが了承されている。
以上
例~6 例、計 6~12 例で評価する。Phase I 終了時に効果・安全性評価委員会に
よる評価を経て先進医療技術審査部会への報告を行い、本試験の継続に関して
承認を得た後、Phase II 部分から他の実施予定医療機関に施設を拡大する。な
お、Phase I 部分完了に至らない時期においても各レベルで重篤な有害事象が出
現する等安全性上の懸念がある場合は、その時点で効果・安全性評価委員会を
開催し、必要に応じて先進医療技術審査部会へも報告を行う。
【継続の可否に係る独立した委員会の審議結果】
研究代表者及び研究事務局の報告によると、3 例について最初の用量レベル 1
(メトホルミン 1500mg+テモゾロミド)の投与が行われ、用量制限毒性(DLT)に
相当する有害事象はなく、用量レベル 2(メトホルミン 2250mg+テモゾロミド)
に進むこととなった。用量レベル 2 の第一例目は、grade 2 の食欲不振の報告が
あったが、試験実施計画書「2.4.2.2.DLT の定義」に規定している手順に従い、
効果安全性評価委員 2 名に諮ったところ、テモゾロミドとの併用前のメトホル
ミン単独投与時の食欲不振の報告であるという理由で、 DLT 評価対象例としな
いこととなった。その他の用量レベル 2 に登録された 3 例において事前投与期
間を含むメトホルミン併用テモゾロミド維持治療 2 コース目開始までの観察が
終了し、データが収集・確認された。
効果・安全性評価委員会での審議の結果、「用量制限毒性(DLT)もしくは用
量制限毒性(DLT)に類する有害事象の発現はなく、用量レベル 2 で PhaseII へ
移行する」と判断された。
その結果を受けて、先進医療技術審査部会構成員(主担当、副担当(生物統
計担当))及び技術専門委員によってご審議(メール稟議)いただいた結果、
先進医療継続可との評価を得たため、新規症例登録が再開された(※)。
(※)第 59 回先進医療技術審査部会にて、評価に必要な数症例の試験結果および、その結
果について独立データモニタリング委員会等で審議された結果を、評価担当構成員(申請
時の主担当、副担当(生物統計担当))の先生方にご確認いただき、先進医療継続の可否
についてご評価(メール稟議)いただくこと、継続可となれば速やかに試験を再開してよ
いこととし、後日先進医療技術審査部会に報告することが了承されている。
以上