よむ、つかう、まなぶ。
資料4 先進医療Bの試験実施計画の変更について(告示番号52) (2 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_25067.html |
| 出典情報 | 先進医療会議 先進医療技術審査部会(第132回 4/18)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
置『COM.TEC』を使用することとしており、
『COM.TEC』とともにディ
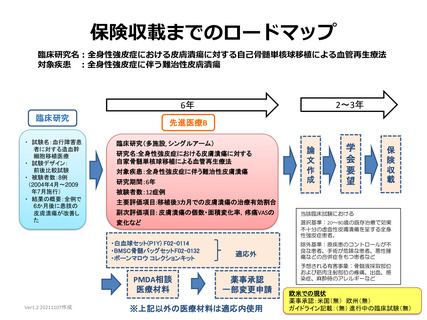
スポーザブル製品として『白血球セット(P1Y) F02-011』及び『BMSC 骨
髄バッグセット F02-0132』を薬事適応外使用することとしていた。他方
で、本試験に参加する予定の4つの医療機関では、骨髄から単核球を分離
する際に用いる医療材料として、テルモ BCT 社の遠心型血球分離装置『ス
ペクトラオプティア』を使用することとしており、『スペクトラオプティ
ア』とともにディスポーザブル製品として『スペクトラオプティア用血液
回路 IDL セット』及び『スペクトラオプティア用血液回路 BMP セット』
を使用する為、下記の理由によりいずれの医療材料も使用可とする。
(「変
更申請する理由」①参照)
なお、テルモ BCT 社のディスポーザブル製品は、当該使用方法について薬
事適応を有している。
② その他記載整備
【変更申請する理由】
① テルモBCT株式会社のディスポーザブル製品(薬事適応内)とフレゼニウ
スカービジャパン株式会社のディスポーザブル製品(薬事適応外)に関
して、性能が表記された資料はないが、血液成分分離装置本体の性能に
ついては、テルモBCT株式会社のSpectra Optiaとフレゼニウスカービジ
ャパン株式会社のCOM.TECにおける単核球分離の性能について比較した文
献がある(Steininger PA, et al. Vox Sang.2014, 106,248-255)。前
者製品において後者製品と比較してリンパ球が少なく単球が多めである
ことや、血小板や赤血球の混入が少ない、といった点に有意差はある
が、単核球数は同等との結果であった。
血液成分分離装置本体については両社製品とも薬事適応内であり、本医
療技術を施行するにあたっては、必要な単核球細胞数を特定細胞加工物
標準書において規定し、単核球細胞数を測定する。
従って、分離過程で使用される医療機器及び医療材料が異なっていたと
しても、期待される効果は同等と考えられる。
② 人事異動に伴う修正、費用修正、先進医療告示に合わせた記載整備等
【試験実施計画の変更承認状況】
2022 年 3 月 23 日付京都府立大学認定再生医療等委員会から「適」との意見書
を受理した。(2022 年2月 21 日作成プロトコル Ver1.3.1)
以上
『COM.TEC』とともにディ
スポーザブル製品として『白血球セット(P1Y) F02-011』及び『BMSC 骨
髄バッグセット F02-0132』を薬事適応外使用することとしていた。他方
で、本試験に参加する予定の4つの医療機関では、骨髄から単核球を分離
する際に用いる医療材料として、テルモ BCT 社の遠心型血球分離装置『ス
ペクトラオプティア』を使用することとしており、『スペクトラオプティ
ア』とともにディスポーザブル製品として『スペクトラオプティア用血液
回路 IDL セット』及び『スペクトラオプティア用血液回路 BMP セット』
を使用する為、下記の理由によりいずれの医療材料も使用可とする。
(「変
更申請する理由」①参照)
なお、テルモ BCT 社のディスポーザブル製品は、当該使用方法について薬
事適応を有している。
② その他記載整備
【変更申請する理由】
① テルモBCT株式会社のディスポーザブル製品(薬事適応内)とフレゼニウ
スカービジャパン株式会社のディスポーザブル製品(薬事適応外)に関
して、性能が表記された資料はないが、血液成分分離装置本体の性能に
ついては、テルモBCT株式会社のSpectra Optiaとフレゼニウスカービジ
ャパン株式会社のCOM.TECにおける単核球分離の性能について比較した文
献がある(Steininger PA, et al. Vox Sang.2014, 106,248-255)。前
者製品において後者製品と比較してリンパ球が少なく単球が多めである
ことや、血小板や赤血球の混入が少ない、といった点に有意差はある
が、単核球数は同等との結果であった。
血液成分分離装置本体については両社製品とも薬事適応内であり、本医
療技術を施行するにあたっては、必要な単核球細胞数を特定細胞加工物
標準書において規定し、単核球細胞数を測定する。
従って、分離過程で使用される医療機器及び医療材料が異なっていたと
しても、期待される効果は同等と考えられる。
② 人事異動に伴う修正、費用修正、先進医療告示に合わせた記載整備等
【試験実施計画の変更承認状況】
2022 年 3 月 23 日付京都府立大学認定再生医療等委員会から「適」との意見書
を受理した。(2022 年2月 21 日作成プロトコル Ver1.3.1)
以上