よむ、つかう、まなぶ。
資料4 先進医療Bの試験実施計画の変更について(告示番号52) (3 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_25067.html |
| 出典情報 | 先進医療会議 先進医療技術審査部会(第132回 4/18)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
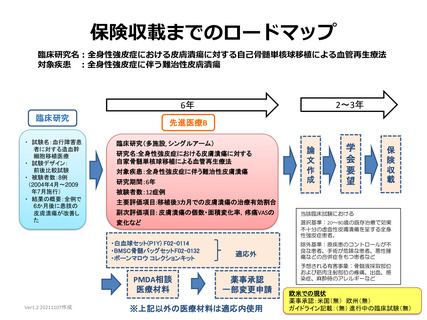
保険収載までのロードマップ
臨床研究名:全身性強皮症における皮膚潰瘍に対する自己骨髄単核球移植による血管再生療法
対象疾患 :全身性強皮症に伴う難治性皮膚潰瘍
2~3年
6年
臨床研究
・ 試験名:血行障害患
者に対する造血幹
細胞移植医療
・ 試験デザイン:
前後比較試験
・ 被験者数:8例
(2004年4月~2009
年7月施行)
・ 結果の概要:全例で
6か月後に患肢の
皮膚潰瘍が改善し
た
先進医療B
臨床研究(多施設, シングルアーム)
研究名:全身性強皮症における皮膚潰瘍に対する
自家骨髄単核球移植による血管再生療法
対象疾患:全身性強皮症に伴う難治性皮膚潰瘍
研究期間:6年
学
会
要
望
保
険
収
載
被験者数:12症例
主要評価項目:移植後3カ月での皮膚潰瘍の治療有効割合
副次評価項目: 皮膚潰瘍の個数・面積変化率,疼痛VASの
当該臨床試験における
変化など
選択基準:20~80歳の既存治療で効果
不十分の虚血性皮膚潰瘍を呈する全身
性強皮症患者。
・白血球セット(P1Y) F02-0114
・BMSC骨髄バッグセットF02-0132
・ボーンマロウ コレクションキット
PMDA相談
医療材料
Ver1.2 20211107作成
論
文
作
成
適応外
薬事承認
一部変更申請
※上記以外の医療材料は適応内使用
除外基準:原疾患のコントロールが不
良な患者、手術が危険な患者、悪性腫
瘍などの合併症をもつ患者など
予想される有害事象:骨髄液採取部位
および筋肉注射部位の疼痛、出血、感
染症、麻酔時のアレルギーなど
欧米での現状
薬事承認:米国(無) 欧州(無)
ガイドライン記載:(無) 進行中の臨床試験(無)
臨床研究名:全身性強皮症における皮膚潰瘍に対する自己骨髄単核球移植による血管再生療法
対象疾患 :全身性強皮症に伴う難治性皮膚潰瘍
2~3年
6年
臨床研究
・ 試験名:血行障害患
者に対する造血幹
細胞移植医療
・ 試験デザイン:
前後比較試験
・ 被験者数:8例
(2004年4月~2009
年7月施行)
・ 結果の概要:全例で
6か月後に患肢の
皮膚潰瘍が改善し
た
先進医療B
臨床研究(多施設, シングルアーム)
研究名:全身性強皮症における皮膚潰瘍に対する
自家骨髄単核球移植による血管再生療法
対象疾患:全身性強皮症に伴う難治性皮膚潰瘍
研究期間:6年
学
会
要
望
保
険
収
載
被験者数:12症例
主要評価項目:移植後3カ月での皮膚潰瘍の治療有効割合
副次評価項目: 皮膚潰瘍の個数・面積変化率,疼痛VASの
当該臨床試験における
変化など
選択基準:20~80歳の既存治療で効果
不十分の虚血性皮膚潰瘍を呈する全身
性強皮症患者。
・白血球セット(P1Y) F02-0114
・BMSC骨髄バッグセットF02-0132
・ボーンマロウ コレクションキット
PMDA相談
医療材料
Ver1.2 20211107作成
論
文
作
成
適応外
薬事承認
一部変更申請
※上記以外の医療材料は適応内使用
除外基準:原疾患のコントロールが不
良な患者、手術が危険な患者、悪性腫
瘍などの合併症をもつ患者など
予想される有害事象:骨髄液採取部位
および筋肉注射部位の疼痛、出血、感
染症、麻酔時のアレルギーなど
欧米での現状
薬事承認:米国(無) 欧州(無)
ガイドライン記載:(無) 進行中の臨床試験(無)