よむ、つかう、まなぶ。
【資料7】欧州製薬団体連合会(EFPIA)提出資料 (3 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_26202.html |
| 出典情報 | 革新的医薬品・医療機器創出のための官民対話(第5回 6/14)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
革新的医薬品創出推進に向けてのEFPIAからの提案
“オープンな日本型エコシステム”の構築
革新的医薬品を創出し日本の患者さんに一日でも早く届けることを目的に、
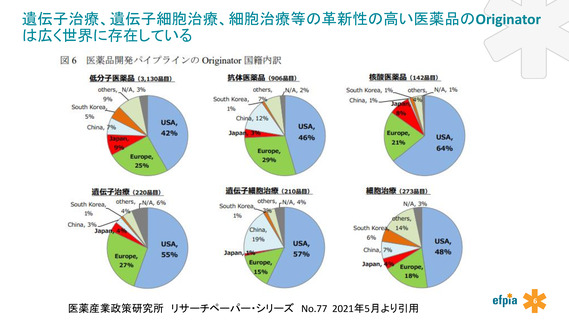
アカデミア・ベンチャーからのシーズの起源や、開発・承認取得を行う製薬会社の国籍に拘らない国際的に“オープンな日本型エコシステ
ム”の構築を提案する。
検証的臨床試験の主要な成績に基づき新薬承認の審査を開始する制度の導入
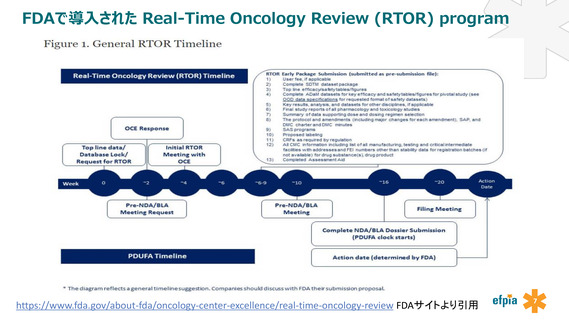
革新的医薬品が欧米から遅れることなく日本でも承認取得されるために、
既に米国で導入されている検証的臨床試験の主要な成績に基づき新薬承認の審査を開始する制度を導入し、正式な承認申請から
承認までの期間をより短縮することを提案する。
臨床研究中核病院と産業側の連携推進の場の設置
日本において今後も革新的医薬品の開発を継続するために、
国際的に比較しても効率的な治験オペレーションの実現が不可欠である。効率化に向けて例えば、DCTの導入、症例集積能力の向上
やIRBの集約といったことについて議論を行うことを提案する。
革新性の高い医薬品開発での産官学連携を促進する議論の場の設置
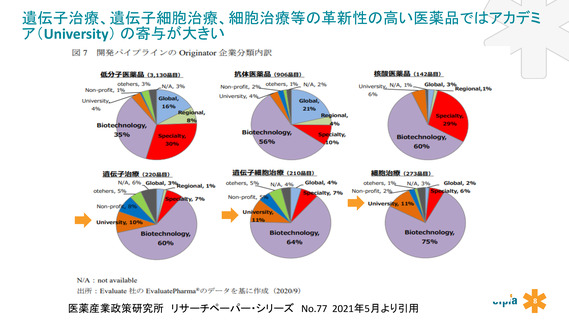
アカデミアの役割が大きく・重要な再生医療品等の革新性の高い医薬品開発を迅速に進めるために、
アカデミアに対する官による技術面の支援制度の充実、規制要件や開発ガイドラインの検討段階から産官学で連携して議論する場を
設けることを提案する。
3
“オープンな日本型エコシステム”の構築
革新的医薬品を創出し日本の患者さんに一日でも早く届けることを目的に、
アカデミア・ベンチャーからのシーズの起源や、開発・承認取得を行う製薬会社の国籍に拘らない国際的に“オープンな日本型エコシステ
ム”の構築を提案する。
検証的臨床試験の主要な成績に基づき新薬承認の審査を開始する制度の導入
革新的医薬品が欧米から遅れることなく日本でも承認取得されるために、
既に米国で導入されている検証的臨床試験の主要な成績に基づき新薬承認の審査を開始する制度を導入し、正式な承認申請から
承認までの期間をより短縮することを提案する。
臨床研究中核病院と産業側の連携推進の場の設置
日本において今後も革新的医薬品の開発を継続するために、
国際的に比較しても効率的な治験オペレーションの実現が不可欠である。効率化に向けて例えば、DCTの導入、症例集積能力の向上
やIRBの集約といったことについて議論を行うことを提案する。
革新性の高い医薬品開発での産官学連携を促進する議論の場の設置
アカデミアの役割が大きく・重要な再生医療品等の革新性の高い医薬品開発を迅速に進めるために、
アカデミアに対する官による技術面の支援制度の充実、規制要件や開発ガイドラインの検討段階から産官学で連携して議論する場を
設けることを提案する。
3