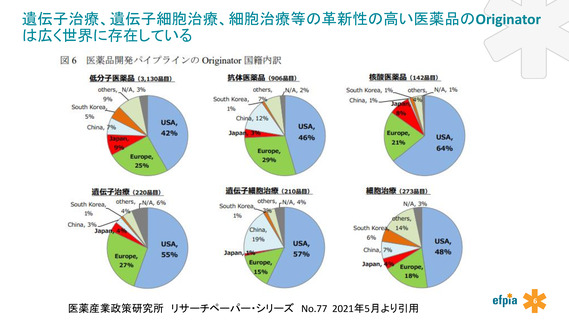
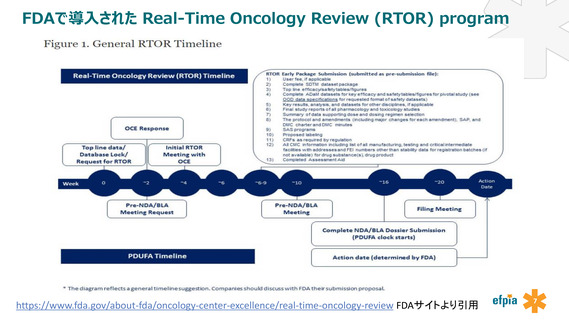
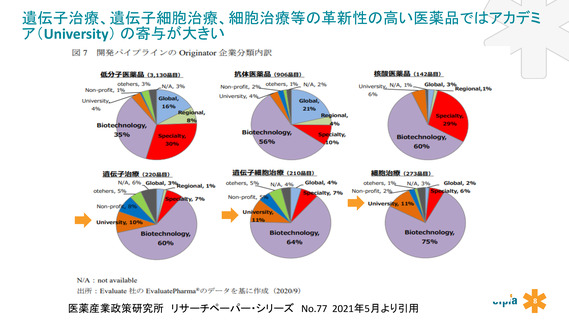
よむ、つかう、まなぶ。
【資料7】欧州製薬団体連合会(EFPIA)提出資料 (4 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_26202.html |
| 出典情報 | 革新的医薬品・医療機器創出のための官民対話(第5回 6/14)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
グローバルでみても日本の医薬品市場の魅力を維持するために
イノベーションが適切に評価されることが、更なるイノベーション創出に繋がる。
医薬品産業ビジョンの推進とともに、「イノベーション評価の強化」について継続的に議論することを求める。
具体的に検討すべき項目
薬価制度の
予見性確保
「国民皆保険制度
の持続性」と
「イノベーションの
推進」の両立
•
頻繁なルール改定の是正とルール改定から実施までの期間の是正
(2016年以降3回の改定で56項目のルール改定、12月決定で4月実施)
•
中間年改定の対象範囲の見直し
•
特許期間中の医薬品の薬価水準の維持
•
新薬創出加算におけるイノベーションの評価の拡充
イノベーション評価
の強化
•
費用対効果評価
制度の見直し
(急な運用見直しの是正、対象品目の拡充)
市販後に得られたエビデンスに基づく有用性評価
•
希少疾患(指定難病を含む)に対する医薬品・再生医療等製品は費用対効果評価
から除外する原則の徹底
•
追加適応に対する費用対効果評価の除外
4
イノベーションが適切に評価されることが、更なるイノベーション創出に繋がる。
医薬品産業ビジョンの推進とともに、「イノベーション評価の強化」について継続的に議論することを求める。
具体的に検討すべき項目
薬価制度の
予見性確保
「国民皆保険制度
の持続性」と
「イノベーションの
推進」の両立
•
頻繁なルール改定の是正とルール改定から実施までの期間の是正
(2016年以降3回の改定で56項目のルール改定、12月決定で4月実施)
•
中間年改定の対象範囲の見直し
•
特許期間中の医薬品の薬価水準の維持
•
新薬創出加算におけるイノベーションの評価の拡充
イノベーション評価
の強化
•
費用対効果評価
制度の見直し
(急な運用見直しの是正、対象品目の拡充)
市販後に得られたエビデンスに基づく有用性評価
•
希少疾患(指定難病を含む)に対する医薬品・再生医療等製品は費用対効果評価
から除外する原則の徹底
•
追加適応に対する費用対効果評価の除外
4