よむ、つかう、まなぶ。
in vivo遺伝子治療に対する規制の検討(法の対象とする関連技術の範囲について) (20 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_26505.html |
| 出典情報 | 再生医療等安全性確保法の見直しに係るワーキンググループ(第6回 6/29)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
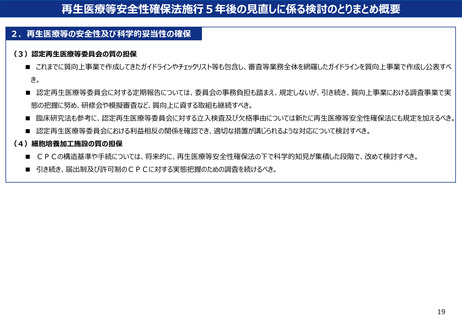
再生医療等安全性確保法施行5年後の見直しに係る検討のとりまとめ概要
3.再生医療等に係る研究の推進
(1)法に基づく手続の緩和・改善
<手続の責任主体について>
■ 再生医療等を研究として行う場合、研究特有の手続については、当該研究の実施責任者において行うこととすべき。
<先進医療の手続について>
■ 先進医療として臨床研究を実施する場合(一定の要件を満たした医療機関からの提出、かつ、一定の要件を満たした認定再生医療等委員会の審
査を経た場合)における、先進医療技術審査部会及び先進医療会議の審査過程の簡略化について、まずは先進医療技術審査部会で検討すべき。
■ 先進医療として実施する臨床研究において、認定再生医療等委員会における審査の後、先進医療技術審査部会又は先進医療会議において研究
計画書等に変更があった場合、当該変更に係る認定再生医療等委員会の審査等業務については、事後的に認定再生医療等委員会へ報告すること
とすべき。
(2)再生医療等の拠点機関の設定
■ 拠点機関の設定については、再生医療実用化基盤整備促進事業の中で設定された拠点機関を中心に多機関連携を支援することとし、拠点機関
の数や各機関の役割については、状況に応じて関係者間での調整のうえ、適切に設定すべき。
■ 遺伝子治療を牽引する拠点機関の設定についても検討すべき。
(3)細胞の安定的な確保
■ 流通に係る基盤の構築や原料の品質管理に係る基準の策定に向けて、引き続き、経済産業省をはじめ関係省庁等と連携し、検討を進めていくべき。
■ 本部会においては、再生医療等安全性確保法のあり方について議論を行い、見直しに係る検討をとりまとめた。
■ 本部会の意見を十分に踏まえ、再生医療等安全性確保法の改正を行う等、改革に早急に取り組み、着実に実施されたい。
20
3.再生医療等に係る研究の推進
(1)法に基づく手続の緩和・改善
<手続の責任主体について>
■ 再生医療等を研究として行う場合、研究特有の手続については、当該研究の実施責任者において行うこととすべき。
<先進医療の手続について>
■ 先進医療として臨床研究を実施する場合(一定の要件を満たした医療機関からの提出、かつ、一定の要件を満たした認定再生医療等委員会の審
査を経た場合)における、先進医療技術審査部会及び先進医療会議の審査過程の簡略化について、まずは先進医療技術審査部会で検討すべき。
■ 先進医療として実施する臨床研究において、認定再生医療等委員会における審査の後、先進医療技術審査部会又は先進医療会議において研究
計画書等に変更があった場合、当該変更に係る認定再生医療等委員会の審査等業務については、事後的に認定再生医療等委員会へ報告すること
とすべき。
(2)再生医療等の拠点機関の設定
■ 拠点機関の設定については、再生医療実用化基盤整備促進事業の中で設定された拠点機関を中心に多機関連携を支援することとし、拠点機関
の数や各機関の役割については、状況に応じて関係者間での調整のうえ、適切に設定すべき。
■ 遺伝子治療を牽引する拠点機関の設定についても検討すべき。
(3)細胞の安定的な確保
■ 流通に係る基盤の構築や原料の品質管理に係る基準の策定に向けて、引き続き、経済産業省をはじめ関係省庁等と連携し、検討を進めていくべき。
■ 本部会においては、再生医療等安全性確保法のあり方について議論を行い、見直しに係る検討をとりまとめた。
■ 本部会の意見を十分に踏まえ、再生医療等安全性確保法の改正を行う等、改革に早急に取り組み、着実に実施されたい。
20