よむ、つかう、まなぶ。
○令和元年度先進医療技術の実績報告等について資料 先-2-2 (3 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000205617_00016.html |
| 出典情報 | 先進医療会議(第81回 7/7)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
告示
番号
24
技術名
申請医療機関名
0件の理由
医療機関の今後の対応方針
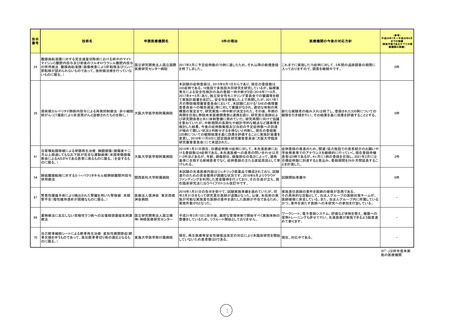
腹膜偽粘液腫に対する完全減量切除術における術中のマイト
マイシンC腹腔内投与及び術後のフルオロウラシル腹腔内投与
国立研究開発法人国立国際 2017年2月に予定症例数の75例に達したため、それ以降の新規登録 これまでに実施した75症例に対して、5年間の追跡調査の期間に
の併用療法 腹膜偽粘液腫(画像検査により肝転移及びリンパ
医療研究センター病院
を終了しました。
入っておりますので、調査を継続中です。
節転移が認められないものであって、放射線治療を行っていな
いものに限る。)
29
周術期カルペリチド静脈内投与による再発抑制療法 非小細胞
大阪大学医学部附属病院
肺がん(CT撮影により非浸潤がんと診断されたものを除く。)
本試験の症例登録は、2015年9月1日からであり、現在の登録数は
335症例である。10施設で多施設共同研究を研究しているが、脳梗塞
発生による安全性検討の為の登録一時中断が2回(2016年7~8月、
2017年4~5月)あり、独立安全性モニタリング委員会での審議等を経
て実施計画書を改訂し、安全性を確保した上で再開したが、2017年7
月の弊院倫理審査委員会において、本試験における「SAEの倫理審
査委員会への報告遅延」等に対して審議がなされ、適切な体制の再
構築の策定まで、研究実施一時中断が決定された。その後、早期の 新たな被験者の組み入れは終了し、登録された335例についての
再開を目指し弊院未来医療開発部と連携を図り、研究責任医師およ 観察を引き続き行い、その結果を基に効果を評価することとする。
び研究関係者と共に体制整備に努めていた。研究再開に向けて協議
を重ねていたが、中断期間の長期化や統計学的な観点など諸事情を
検討した結果、今後の症例数集積及び当初の予定症例数への到達
が極めて難しい状況と判断せざるを得ないと判断し、現在の登録数
335例についての観察結果を基に効果を評価することに実施計画書を
変更し、2018年11月9日に認定臨床研究審査委員会(大阪大学臨床
研究審査委員会)にて承認された。
41
自家嗅粘膜移植による脊髄再生治療 胸髄損傷(損傷後十二
月以上経過してもなお下肢が完全な運動麻痺(米国脊髄損傷
大阪大学医学部附属病院
教会によるAISがAである患者に係るものに限る。)を呈するも
のに限る。)
2019年1月31日現在、目標症例数10症例に対して、本先進医療にお
ける登録数は4症例である。本先進医療への患者の問い合わせは月
1-2件ほどあるが、年齢、損傷部位、損傷部位の長さによって、適格
基準に合致する候補患者でなく、症例登録の主たる遅延原因として挙
げられる。
54
膵癌腹膜転移に対するS-1+パクリタキセル経静脈腹腔内投与
関西医科大学附属病院
併用療法
本試験の先進医療内容はジェネリック医薬品で構成されており、試験
遂行のための資金獲得が困難な状況です。2019年6月よりクラウド
試験開始準備中
ファンディングを利用した資金獲得を行っており、その目途が立ち、現
在臨床研究法に沿うべくプロトコル改訂中です。
67
腎悪性腫瘍手術により摘出された腎臓を用いた腎移植 末期
腎不全(慢性維持透析が困難なものに限る。)
2019年1月31日の告示を受けて、試験実施準備を進めていたが、同
年3月31日をもって研究責任医師が退職となった。以後、本技術の実
施が可能な実施責任医師の要件を満たした医師が不在であるため、
実施件数が0となった。
69
70
症例登録の推進のため、関連・協力施設での患者紹介のお願いや
学会発表等でのアナウンスを継続的に行っていく。現在登録待機
患者は0例であるが、4ヶ月に1例の登録を目指し、2021年3月には
目標症例数に到達すると見込み、登録期間を24か月間延長するこ
とを計画した。
(参考)
平成29年7月~平成30年6月
までの実績
(実施可能であるすべての医
療機関の実績)
0件
0件
2件
0件
実施責任医師の要件を医師の確保が急務である。
その具体的な活動として、当法人グループの医師対策チームが、
医師確保に奔走している。また、当法人グループ内に所属している
かつ、要件を満たす医師への本研究への参加を打診している。
-
薬物療法に反応しない双極性うつ病への反復経頭蓋磁気刺激 国立研究開発法人国立精
療法
神・神経医療研究センター
ワークシート、電子登録システム、評価など体制を整え、機器への
平成31年3月1日に告示後、厳密な管理体制で開始すべく実施体制の
習熟トレーニングも併せて行い、先進医療が実施できるよう鋭意進
整備をしているため、リクルート開始としておりません。
めて参ります。
-
自己軟骨細胞シートによる軟骨再生治療 変形性膝関節症(軟
骨欠損を伴うものであって、高位脛骨骨切り術の適応となるも 東海大学医学部付属病院
のに限る。)
現在、再生医療等安全性確保法改定の対応により本臨床研究を開始
現在、対応中である。
していないため患者数は0である。
-
医療法人徳洲会 東京西徳
洲会病院
※「-」は昨年度未実
施の医療機関
3
番号
24
技術名
申請医療機関名
0件の理由
医療機関の今後の対応方針
腹膜偽粘液腫に対する完全減量切除術における術中のマイト
マイシンC腹腔内投与及び術後のフルオロウラシル腹腔内投与
国立研究開発法人国立国際 2017年2月に予定症例数の75例に達したため、それ以降の新規登録 これまでに実施した75症例に対して、5年間の追跡調査の期間に
の併用療法 腹膜偽粘液腫(画像検査により肝転移及びリンパ
医療研究センター病院
を終了しました。
入っておりますので、調査を継続中です。
節転移が認められないものであって、放射線治療を行っていな
いものに限る。)
29
周術期カルペリチド静脈内投与による再発抑制療法 非小細胞
大阪大学医学部附属病院
肺がん(CT撮影により非浸潤がんと診断されたものを除く。)
本試験の症例登録は、2015年9月1日からであり、現在の登録数は
335症例である。10施設で多施設共同研究を研究しているが、脳梗塞
発生による安全性検討の為の登録一時中断が2回(2016年7~8月、
2017年4~5月)あり、独立安全性モニタリング委員会での審議等を経
て実施計画書を改訂し、安全性を確保した上で再開したが、2017年7
月の弊院倫理審査委員会において、本試験における「SAEの倫理審
査委員会への報告遅延」等に対して審議がなされ、適切な体制の再
構築の策定まで、研究実施一時中断が決定された。その後、早期の 新たな被験者の組み入れは終了し、登録された335例についての
再開を目指し弊院未来医療開発部と連携を図り、研究責任医師およ 観察を引き続き行い、その結果を基に効果を評価することとする。
び研究関係者と共に体制整備に努めていた。研究再開に向けて協議
を重ねていたが、中断期間の長期化や統計学的な観点など諸事情を
検討した結果、今後の症例数集積及び当初の予定症例数への到達
が極めて難しい状況と判断せざるを得ないと判断し、現在の登録数
335例についての観察結果を基に効果を評価することに実施計画書を
変更し、2018年11月9日に認定臨床研究審査委員会(大阪大学臨床
研究審査委員会)にて承認された。
41
自家嗅粘膜移植による脊髄再生治療 胸髄損傷(損傷後十二
月以上経過してもなお下肢が完全な運動麻痺(米国脊髄損傷
大阪大学医学部附属病院
教会によるAISがAである患者に係るものに限る。)を呈するも
のに限る。)
2019年1月31日現在、目標症例数10症例に対して、本先進医療にお
ける登録数は4症例である。本先進医療への患者の問い合わせは月
1-2件ほどあるが、年齢、損傷部位、損傷部位の長さによって、適格
基準に合致する候補患者でなく、症例登録の主たる遅延原因として挙
げられる。
54
膵癌腹膜転移に対するS-1+パクリタキセル経静脈腹腔内投与
関西医科大学附属病院
併用療法
本試験の先進医療内容はジェネリック医薬品で構成されており、試験
遂行のための資金獲得が困難な状況です。2019年6月よりクラウド
試験開始準備中
ファンディングを利用した資金獲得を行っており、その目途が立ち、現
在臨床研究法に沿うべくプロトコル改訂中です。
67
腎悪性腫瘍手術により摘出された腎臓を用いた腎移植 末期
腎不全(慢性維持透析が困難なものに限る。)
2019年1月31日の告示を受けて、試験実施準備を進めていたが、同
年3月31日をもって研究責任医師が退職となった。以後、本技術の実
施が可能な実施責任医師の要件を満たした医師が不在であるため、
実施件数が0となった。
69
70
症例登録の推進のため、関連・協力施設での患者紹介のお願いや
学会発表等でのアナウンスを継続的に行っていく。現在登録待機
患者は0例であるが、4ヶ月に1例の登録を目指し、2021年3月には
目標症例数に到達すると見込み、登録期間を24か月間延長するこ
とを計画した。
(参考)
平成29年7月~平成30年6月
までの実績
(実施可能であるすべての医
療機関の実績)
0件
0件
2件
0件
実施責任医師の要件を医師の確保が急務である。
その具体的な活動として、当法人グループの医師対策チームが、
医師確保に奔走している。また、当法人グループ内に所属している
かつ、要件を満たす医師への本研究への参加を打診している。
-
薬物療法に反応しない双極性うつ病への反復経頭蓋磁気刺激 国立研究開発法人国立精
療法
神・神経医療研究センター
ワークシート、電子登録システム、評価など体制を整え、機器への
平成31年3月1日に告示後、厳密な管理体制で開始すべく実施体制の
習熟トレーニングも併せて行い、先進医療が実施できるよう鋭意進
整備をしているため、リクルート開始としておりません。
めて参ります。
-
自己軟骨細胞シートによる軟骨再生治療 変形性膝関節症(軟
骨欠損を伴うものであって、高位脛骨骨切り術の適応となるも 東海大学医学部付属病院
のに限る。)
現在、再生医療等安全性確保法改定の対応により本臨床研究を開始
現在、対応中である。
していないため患者数は0である。
-
医療法人徳洲会 東京西徳
洲会病院
※「-」は昨年度未実
施の医療機関
3