よむ、つかう、まなぶ。
東京都、アボットメディカルジャパン合同会社報道発表資料 (4 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_27164.html |
| 出典情報 | 医療機器自主回収のお知らせ(クラスI)(7/29)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
2022 年 7 月 29 日
報道関係各位
アボットメディカルジャパン合同会社
植込み型心臓ペースメーカ「アシュリティ MRI」、「ゼネックス MRI」の
患者モニタリング(クラス 1)に関するお知らせ
アボットメディカルジャパン合同会社は、植込み型心臓ペースメーカ「アシュリティ MRI」および
「ゼネックス MRI」につきまして、患者モニタリングを実施することをお知らせいたします。
対象となる製品は全て特定しており、患者さんのフォローアップを実施していただくよう、速やか
に医療機関に依頼しております。下記の患者モニタリング概要に記載の事象が発生した場合は、
ペーシング喪失、 電池寿命の減少、バックアップモードへの移行および/またはテレメトリ/通信の
喪失等がありますが、これまでに患者さんに重大な危害を与えたという報告はありません。
本製品をご使用中の患者さん、および治療に当たられています医療関係者の皆様にご不便とご
心配をおかけすることになりましたことを深くお詫び申し上げます。
1.
一般的名称及び販売名
・ 一般的名称: 植込み型心臓ペースメーカ
・
販 売 名: (1) アシュリティ MRI
: (2) ゼネックス MRI
・
承認番号: (1) 22700BZX00181000
(2) 22700BZX00181A01
・
品
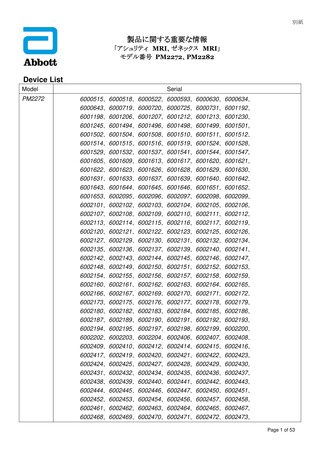
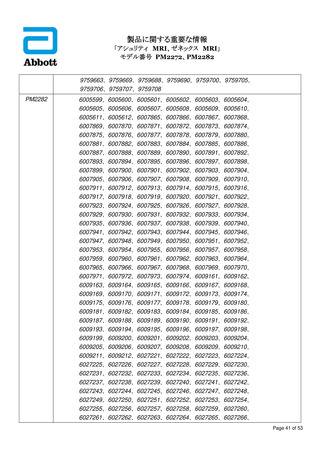
番: (1) PM2272
(2) PM2282
2.
数量及び出荷時期
・数
量: 12,273 台
・ 出荷時期: 2020 年 5 月 12 日から 2022 年 5 月 30 日
3.
患者モニタリング理由
海外製造元の調査結果より特定された一つの製造ラインで使用されていたレーザー設備におけ
る表面処理工程において、デバイスの金属製のケース(カン)の事前処理が適切に施されず、デ
バイスとヘッダの接着状態が通常と異なる状態に至ったことにより、パルスジェネレータのヘッダ
に水分が混入し、電気的問題が発生する可能性があることが確認されました。
このため、医療機関に対し、対象の製品が植え込まれている患者さんに関する定期的なフォロー
1
報道関係各位
アボットメディカルジャパン合同会社
植込み型心臓ペースメーカ「アシュリティ MRI」、「ゼネックス MRI」の
患者モニタリング(クラス 1)に関するお知らせ
アボットメディカルジャパン合同会社は、植込み型心臓ペースメーカ「アシュリティ MRI」および
「ゼネックス MRI」につきまして、患者モニタリングを実施することをお知らせいたします。
対象となる製品は全て特定しており、患者さんのフォローアップを実施していただくよう、速やか
に医療機関に依頼しております。下記の患者モニタリング概要に記載の事象が発生した場合は、
ペーシング喪失、 電池寿命の減少、バックアップモードへの移行および/またはテレメトリ/通信の
喪失等がありますが、これまでに患者さんに重大な危害を与えたという報告はありません。
本製品をご使用中の患者さん、および治療に当たられています医療関係者の皆様にご不便とご
心配をおかけすることになりましたことを深くお詫び申し上げます。
1.
一般的名称及び販売名
・ 一般的名称: 植込み型心臓ペースメーカ
・
販 売 名: (1) アシュリティ MRI
: (2) ゼネックス MRI
・
承認番号: (1) 22700BZX00181000
(2) 22700BZX00181A01
・
品
番: (1) PM2272
(2) PM2282
2.
数量及び出荷時期
・数
量: 12,273 台
・ 出荷時期: 2020 年 5 月 12 日から 2022 年 5 月 30 日
3.
患者モニタリング理由
海外製造元の調査結果より特定された一つの製造ラインで使用されていたレーザー設備におけ
る表面処理工程において、デバイスの金属製のケース(カン)の事前処理が適切に施されず、デ
バイスとヘッダの接着状態が通常と異なる状態に至ったことにより、パルスジェネレータのヘッダ
に水分が混入し、電気的問題が発生する可能性があることが確認されました。
このため、医療機関に対し、対象の製品が植え込まれている患者さんに関する定期的なフォロー
1