よむ、つかう、まなぶ。
資料3-1 代謝・その他WG (4 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00024.html |
| 出典情報 | 医療上の必要性の高い未承認薬・適応外薬検討会議(第52回 8/31)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
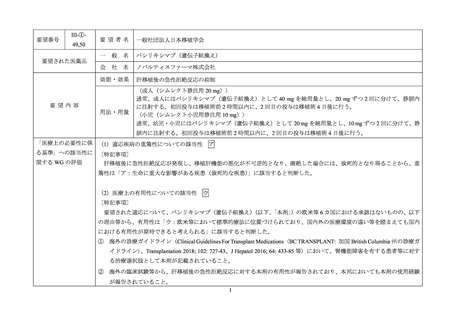
要望番号
IV-94,141
要望された医薬品
要望者名
一般社団法人日本造血・免疫細胞療法学会
一般名
シクロホスファミド水和物
会社名
塩野義製薬株式会社
効能・効果
血縁者間同種造血細胞移植(HLA 半合致移植)時の移植片対宿主病の抑制
要望内容
用法・用量
シクロホスファミド(無水物換算)として、1 日 1 回 50 mg/kg を 2~3 時間かけて点滴静注し、移植後 3 日目、4
日目、または移植後 3 日目、5 日目の 2 日間投与する。
「医療上の必要性に係 (1)適応疾病の重篤性についての該当性
ア
る基準」への該当性に 〔特記事項〕
関する WG の評価
造血幹細胞移植における移植片対宿主病(以下、
「GVHD」
)は、移植関連死の主要な一因であることから、重篤性は「ア:生
命に重大な影響がある疾患(致死的な疾患)
」に該当すると判断した。
(2)医療上の有用性についての該当性
ウ
〔特記事項〕
要望された適応について、シクロホスファミドの欧米等 6 カ国における承認はないものの、以下の理由等から、有用性は「ウ:
欧米等において標準的療法に位置づけられており、国内外の医療環境の違い等を踏まえても国内における有用性が期待できると
考えられる」に該当すると判断した。
① 海外の診療ガイドライン(Biol Blood Marrow Transplant 2019; 25: 2113-23、Haematologica 2017; 102: 1810-22)、及び国内の診
療ガイドライン(造血細胞移植ガイドライン HLA 不適合血縁者間移植 第 2 版)において、移植後シクロホスファミドを用
いた HLA 半合致移植が記載されていること。
② 国内外の臨床試験等から、HLA 半合致移植の GVHD に対する移植後シクロホスファミドの有用性が報告されていること。
備考
3
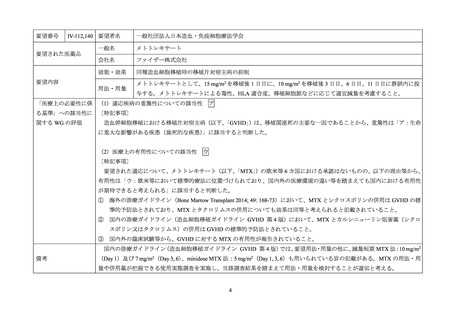
IV-94,141
要望された医薬品
要望者名
一般社団法人日本造血・免疫細胞療法学会
一般名
シクロホスファミド水和物
会社名
塩野義製薬株式会社
効能・効果
血縁者間同種造血細胞移植(HLA 半合致移植)時の移植片対宿主病の抑制
要望内容
用法・用量
シクロホスファミド(無水物換算)として、1 日 1 回 50 mg/kg を 2~3 時間かけて点滴静注し、移植後 3 日目、4
日目、または移植後 3 日目、5 日目の 2 日間投与する。
「医療上の必要性に係 (1)適応疾病の重篤性についての該当性
ア
る基準」への該当性に 〔特記事項〕
関する WG の評価
造血幹細胞移植における移植片対宿主病(以下、
「GVHD」
)は、移植関連死の主要な一因であることから、重篤性は「ア:生
命に重大な影響がある疾患(致死的な疾患)
」に該当すると判断した。
(2)医療上の有用性についての該当性
ウ
〔特記事項〕
要望された適応について、シクロホスファミドの欧米等 6 カ国における承認はないものの、以下の理由等から、有用性は「ウ:
欧米等において標準的療法に位置づけられており、国内外の医療環境の違い等を踏まえても国内における有用性が期待できると
考えられる」に該当すると判断した。
① 海外の診療ガイドライン(Biol Blood Marrow Transplant 2019; 25: 2113-23、Haematologica 2017; 102: 1810-22)、及び国内の診
療ガイドライン(造血細胞移植ガイドライン HLA 不適合血縁者間移植 第 2 版)において、移植後シクロホスファミドを用
いた HLA 半合致移植が記載されていること。
② 国内外の臨床試験等から、HLA 半合致移植の GVHD に対する移植後シクロホスファミドの有用性が報告されていること。
備考
3