よむ、つかう、まなぶ。
資料5-2 企業から提出された開発工程表における進捗について (2 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00024.html |
| 出典情報 | 医療上の必要性の高い未承認薬・適応外薬検討会議(第52回 8/31)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
2.開発工程表における進捗
前回会議からの進捗は以下のとおり。
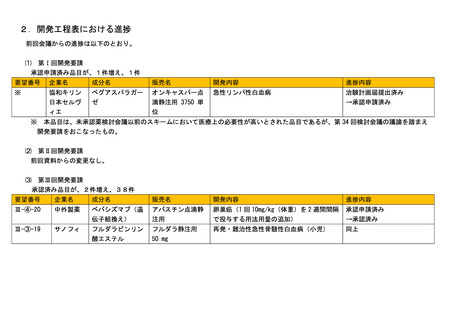
⑴ 第Ⅰ回開発要請
承認申請済み品目が、1件増え、1件
要望番号
企業名
成分名
販売名
開発内容
進捗内容
※
協和キリン
ペグアスパラガー
オンキャスパー点
急性リンパ性白血病
治験計画届提出済み
日本セルヴ
ィエ
ゼ
滴静注用 3750 単
位
→承認申請済み
※
本品目は、未承認薬検討会議以前のスキームにおいて医療上の必要性が高いとされた品目であるが、第 34 回検討会議の議論を踏まえ
開発要請をおこなったもの。
⑵ 第Ⅱ回開発要請
前回資料からの変更なし。
⑶
第Ⅲ回開発要請
承認済み品目が、2件増え、38件
要望番号
企業名
成分名
販売名
開発内容
進捗内容
Ⅲ-④-20
中外製薬
ベバシズマブ(遺
伝子組換え)
アバスチン点滴静
注用
卵巣癌(1 回 10mg/kg(体重)を 2 週間間隔
で投与する用法用量の追加)
承認申請済み
→承認済み
Ⅲ-③-19
サノフィ
フルダラビンリン
酸エステル
フルダラ静注用
50 mg
再発・難治性急性骨髄性白血病(小児)
同上
前回会議からの進捗は以下のとおり。
⑴ 第Ⅰ回開発要請
承認申請済み品目が、1件増え、1件
要望番号
企業名
成分名
販売名
開発内容
進捗内容
※
協和キリン
ペグアスパラガー
オンキャスパー点
急性リンパ性白血病
治験計画届提出済み
日本セルヴ
ィエ
ゼ
滴静注用 3750 単
位
→承認申請済み
※
本品目は、未承認薬検討会議以前のスキームにおいて医療上の必要性が高いとされた品目であるが、第 34 回検討会議の議論を踏まえ
開発要請をおこなったもの。
⑵ 第Ⅱ回開発要請
前回資料からの変更なし。
⑶
第Ⅲ回開発要請
承認済み品目が、2件増え、38件
要望番号
企業名
成分名
販売名
開発内容
進捗内容
Ⅲ-④-20
中外製薬
ベバシズマブ(遺
伝子組換え)
アバスチン点滴静
注用
卵巣癌(1 回 10mg/kg(体重)を 2 週間間隔
で投与する用法用量の追加)
承認申請済み
→承認済み
Ⅲ-③-19
サノフィ
フルダラビンリン
酸エステル
フルダラ静注用
50 mg
再発・難治性急性骨髄性白血病(小児)
同上