よむ、つかう、まなぶ。
【資料2-8】 遠藤構成員からの提出資料 (3 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_27702.html |
| 出典情報 | 医薬品の迅速かつ安定的な供給のための流通・薬価制度に関する有識者検討会(第1回 8/31)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
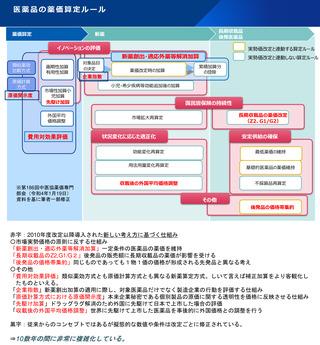
令和4年薬価制度改革
革新的な医薬品のイノベーション評価に関する見直しの全体像
○ 革新的な医薬品におけるイノベーションの評価の観点から、既収載品について、新規収載時であれば有用性加算等に相当す
る効能・効果等が追加された場合には、対象領域等の一定の要件を付した上で、新薬創出等加算の対象とする。
○ 小児用医薬品等の開発促進の観点から、薬機法改正により新設された「先駆的医薬品」及び「特定用途医薬品」を評価。
【イノベーション評価の全体像】※赤字・赤枠が見直し部分(下線が追加、取消線が削除箇所)
新規収載時/初回薬事承認時
薬価改定時/効能追加承認等時
算定薬価への加算
新創加算の適用
薬価への加算
有用性の高い医薬品の開発
○
○
×
新規作用機序医薬品の開発
△
希少疾病の医薬品の開発
○
○
○
○
小児用の医薬品の開発
○
×
○
×
○
○
○
○
開発公募医薬品の開発
×
○
-※3
-※3
薬剤耐性菌の治療薬の開発
△
○
×
○
○ ※4
○ ※4
○
○
-
-
○
○
※特定用途医薬品として指定されたものを除く
先駆的医薬品の開発
世界に先駆けた日本での開発(項目名修正)
※特定用途医薬品として指定されたものを除く
特定用途医薬品の開発(新設)
市販後の真の有用性の検証
○ ※1
×
新創加算の適用
×⇒○※5
○ ※2
※1:革新性・有用性の基準を満たすもののみ、※2:革新性・有用性の基準を満たすもののみ。既存効能と類似性の高いものを除く、※3:通常公募ではなく、開発要請、※4:新規格追加を伴う場
合、※5:薬価改定までに、有用性系の加算(有用性加算(Ⅱ)の要件ニのみに該当する場合を除く)に相当すると認められる効能又は効果が追加されたもの(既存の効能と類似性が高いものを除く)
※第186回中医協薬価専門部会(令和4年1月19日)資料
薬価基準制度の複雑化の例
⇒イノベーションの評価は多様で複雑になっている
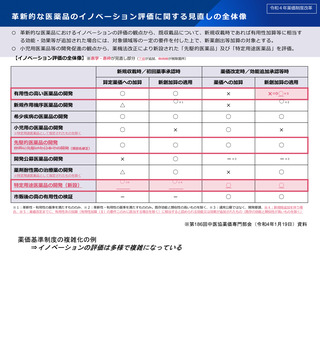
革新的な医薬品のイノベーション評価に関する見直しの全体像
○ 革新的な医薬品におけるイノベーションの評価の観点から、既収載品について、新規収載時であれば有用性加算等に相当す
る効能・効果等が追加された場合には、対象領域等の一定の要件を付した上で、新薬創出等加算の対象とする。
○ 小児用医薬品等の開発促進の観点から、薬機法改正により新設された「先駆的医薬品」及び「特定用途医薬品」を評価。
【イノベーション評価の全体像】※赤字・赤枠が見直し部分(下線が追加、取消線が削除箇所)
新規収載時/初回薬事承認時
薬価改定時/効能追加承認等時
算定薬価への加算
新創加算の適用
薬価への加算
有用性の高い医薬品の開発
○
○
×
新規作用機序医薬品の開発
△
希少疾病の医薬品の開発
○
○
○
○
小児用の医薬品の開発
○
×
○
×
○
○
○
○
開発公募医薬品の開発
×
○
-※3
-※3
薬剤耐性菌の治療薬の開発
△
○
×
○
○ ※4
○ ※4
○
○
-
-
○
○
※特定用途医薬品として指定されたものを除く
先駆的医薬品の開発
世界に先駆けた日本での開発(項目名修正)
※特定用途医薬品として指定されたものを除く
特定用途医薬品の開発(新設)
市販後の真の有用性の検証
○ ※1
×
新創加算の適用
×⇒○※5
○ ※2
※1:革新性・有用性の基準を満たすもののみ、※2:革新性・有用性の基準を満たすもののみ。既存効能と類似性の高いものを除く、※3:通常公募ではなく、開発要請、※4:新規格追加を伴う場
合、※5:薬価改定までに、有用性系の加算(有用性加算(Ⅱ)の要件ニのみに該当する場合を除く)に相当すると認められる効能又は効果が追加されたもの(既存の効能と類似性が高いものを除く)
※第186回中医協薬価専門部会(令和4年1月19日)資料
薬価基準制度の複雑化の例
⇒イノベーションの評価は多様で複雑になっている