よむ、つかう、まなぶ。
資 料1-1 感染症定期報告(研究報告概要一覧表及び個別症例報告概要) (2 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_27906.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会血液事業部会(令和4年度第2回 9/14)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
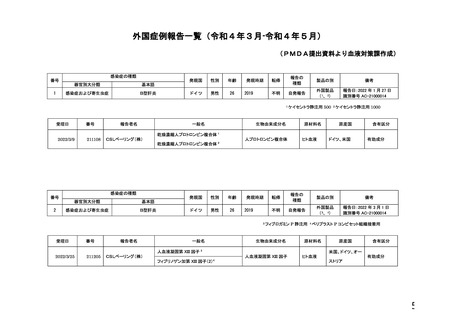
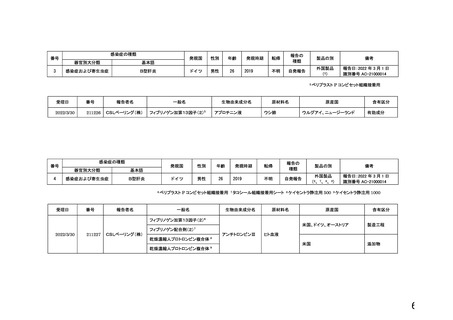
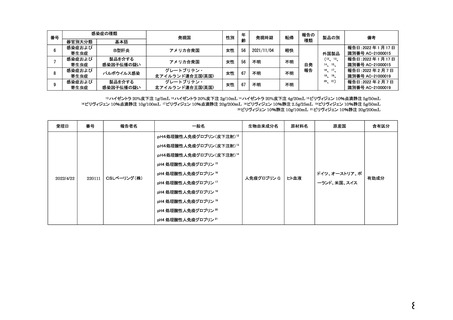
PMDA提出資料より血液対策課作成(令和4年3月-令和4年5月)
感染症
出典
概要
番号
詳細版
ページ
〇NAT検査陰性のHBVウインドウ期の血液を輸血された患者に
おけるHBVの長期潜伏
輸血によるHBV感染(TT-HBV)は、血液スクリーニングの継続的
な改善により大幅に減少したが、いまだにごく少数例が報告され
ている。個別NAT陰性血による輸血後HBV感染の特徴は明らか
になっていない。急性骨髄性白血病に罹患した76歳女性が、個
別NAT陰性の成分採血による血小板製剤の輸血後に肝炎を発
症した。供血者及び受血者検体を用いてダイレクトシーケンス法
によるHBV遺伝子の解析を行ったところ、両検体間に塩基配列
の相同性が認められ、輸血に起因するHBV感染と確定された。
HBV-DNAが輸血後5か月近く潜伏したまれな症例である。(個別
NAT導入後、日本で報告された最も長い潜伏期間は84日であっ
た。)HBVの遺伝子型A2は複製速度が遅く、本症例の長期の潜
伏期間に寄与した可能性がある。また、血小板製剤が多量の血
漿成分を含むことや、血液腫瘍患者における免疫応答がHBV感
染の成立に寄与した可能性がある。このような状況は、過去に日
本で確認された個別NAT陰性血液による輸血後HBV感染3症例
の分析結果と同様である。個別NAT陰性のHBVウインドウ期の
血液に由来する血液を輸血した場合、3か月より長期間のHBV感
染の継続的なモニタリングを行う必要がある。
1
1
ジカウイルス(ZIKV)はもはや関連性のある輸血感染症ではない
というFDAの決定に関する血液事業所向けの情報:FDAは、FDA
の規制で概説されている特定の条件が満たされた場合に、血液
製剤の安全性に影響を与える可能性のある新型または新興感
染症について、献血後の血液を検査することを血液事業所に要
求している。具体的には、輸血感染症が潜在的なドナー集団に
影響を与えるのに十分な発生率および/または有病率を有する
可能性があり、FDAの規制に記載されている他の特定の基準を
満たしている場合、FDAはその輸血感染症をRTTIであると決定
することができる。RTTIの検査は、FDAの認可、承認、またはクリ
アされたスクリーニング検査が利用可能であり、感染のリスクを
十分かつ適切に低減するために検査が必要な場合、FDAの規制
の下で要求される。FDAは、ZIKVはもはや潜在的なドナー集団に
影響を与えるのに十分な発生率および/または有病率ではない
ことが証明されたため、FDAの規制におけるRTTIではないと判断
した。従って、FDAは、2018年7月付けのガイダンス「血液および
血液成分によるジカウイルス伝播のリスクを低減するための推
奨事項(改定版)」を撤回した。ZIKVはRTTIではなくなったため、
血液事業所はZIKVの検査を中止することができる。献血のZIKV
検査を中止する認可血液事業所は、21 CFR 601.12(d)に基づく
年次報告書で、検査が中止された日付を記載して、この変更を
FDAに報告する必要がある。情報の回覧に対応する変更は、21
CFR 601.12(d)に基づく年次報告書でも報告する必要がある。
2
8
<肝炎ウイルス>
Transfusion.
B型肝炎 61(2021)27822787
<その他のウイルス>
FDAホームペー
ジ.
https://www.fda.
gov/vaccinesbloodbiologics/bloodジカウイル bloodス感染 products/inform
ation-bloodestablishmentsregarding-fdasdeterminationzika-virus-nolonger-relevant
1
感染症
出典
概要
番号
詳細版
ページ
〇NAT検査陰性のHBVウインドウ期の血液を輸血された患者に
おけるHBVの長期潜伏
輸血によるHBV感染(TT-HBV)は、血液スクリーニングの継続的
な改善により大幅に減少したが、いまだにごく少数例が報告され
ている。個別NAT陰性血による輸血後HBV感染の特徴は明らか
になっていない。急性骨髄性白血病に罹患した76歳女性が、個
別NAT陰性の成分採血による血小板製剤の輸血後に肝炎を発
症した。供血者及び受血者検体を用いてダイレクトシーケンス法
によるHBV遺伝子の解析を行ったところ、両検体間に塩基配列
の相同性が認められ、輸血に起因するHBV感染と確定された。
HBV-DNAが輸血後5か月近く潜伏したまれな症例である。(個別
NAT導入後、日本で報告された最も長い潜伏期間は84日であっ
た。)HBVの遺伝子型A2は複製速度が遅く、本症例の長期の潜
伏期間に寄与した可能性がある。また、血小板製剤が多量の血
漿成分を含むことや、血液腫瘍患者における免疫応答がHBV感
染の成立に寄与した可能性がある。このような状況は、過去に日
本で確認された個別NAT陰性血液による輸血後HBV感染3症例
の分析結果と同様である。個別NAT陰性のHBVウインドウ期の
血液に由来する血液を輸血した場合、3か月より長期間のHBV感
染の継続的なモニタリングを行う必要がある。
1
1
ジカウイルス(ZIKV)はもはや関連性のある輸血感染症ではない
というFDAの決定に関する血液事業所向けの情報:FDAは、FDA
の規制で概説されている特定の条件が満たされた場合に、血液
製剤の安全性に影響を与える可能性のある新型または新興感
染症について、献血後の血液を検査することを血液事業所に要
求している。具体的には、輸血感染症が潜在的なドナー集団に
影響を与えるのに十分な発生率および/または有病率を有する
可能性があり、FDAの規制に記載されている他の特定の基準を
満たしている場合、FDAはその輸血感染症をRTTIであると決定
することができる。RTTIの検査は、FDAの認可、承認、またはクリ
アされたスクリーニング検査が利用可能であり、感染のリスクを
十分かつ適切に低減するために検査が必要な場合、FDAの規制
の下で要求される。FDAは、ZIKVはもはや潜在的なドナー集団に
影響を与えるのに十分な発生率および/または有病率ではない
ことが証明されたため、FDAの規制におけるRTTIではないと判断
した。従って、FDAは、2018年7月付けのガイダンス「血液および
血液成分によるジカウイルス伝播のリスクを低減するための推
奨事項(改定版)」を撤回した。ZIKVはRTTIではなくなったため、
血液事業所はZIKVの検査を中止することができる。献血のZIKV
検査を中止する認可血液事業所は、21 CFR 601.12(d)に基づく
年次報告書で、検査が中止された日付を記載して、この変更を
FDAに報告する必要がある。情報の回覧に対応する変更は、21
CFR 601.12(d)に基づく年次報告書でも報告する必要がある。
2
8
<肝炎ウイルス>
Transfusion.
B型肝炎 61(2021)27822787
<その他のウイルス>
FDAホームペー
ジ.
https://www.fda.
gov/vaccinesbloodbiologics/bloodジカウイル bloodス感染 products/inform
ation-bloodestablishmentsregarding-fdasdeterminationzika-virus-nolonger-relevant
1