よむ、つかう、まなぶ。
参考資料1 新型コロナワクチン「コミナティ筋注(1価:起源株)」(ファイザー株式会社)添付文書 (4 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000208910_00052.html |
| 出典情報 | 第85回厚生科学審議会予防接種・ワクチン分科会副反応検討部会、令和4年度第14回薬事・食品衛生審議会薬事分科会医薬品等安全対策部会安全対策調査会(合同開催)(10/7)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
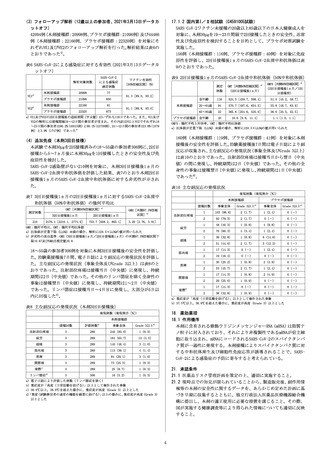
17.1.2 国内第I/Ⅱ相試験(C4591005試験)
SARS-CoV-2ワクチン未接種の20歳以上85歳以下の日本人健康成人を
対象に、本剤30µgを19~23日間隔で2回接種したときの安全性、忍容
性及び免疫原性を検討することを目的として、プラセボ対照試験を
実施した。
156例(本剤接種群:116例、プラセボ接種群:40例)を対象に免疫
原性を評価し、2回目接種後1ヵ月のSARS-CoV-2血清中和抗体価は表
9のとおりであった。
(3)フォローアップ解析(12歳以上の参加者、2021年3月13日データカ
ットオフ)
42094例(本剤接種群:20998例、プラセボ接種群:21096例)及び44486
例(本剤接種群:22166例、プラセボ接種群:22320例)を対象にそ
れぞれVE1及びVE2のフォローアップ解析を行った。解析結果は表6の
とおりであった4)。
表6 SARS-CoV-2による感染症に対する有効性(2021年3月13日データカ
ットオフ)
SARS-CoV-2
による感染症
確定例数
解析対象例数
VE1a)
VE2a)
本剤接種群
20998
77
プラセボ接種群
21096
850
本剤接種群
22166
81
プラセボ接種群
22320
873
表9 2回目接種後1ヵ月のSARS-CoV-2血清中和抗体価(50%中和抗体価)
ワクチン有効性
[95%信頼区間](%)
測定
例数
91.3[89.0, 93.2]
本剤接種群
91.1[88.8, 93.0]
a)VE1及びVE2の2回目接種後の追跡期間(中央値)はいずれも118日であった。また、VE1及び
VE2の解析には接種間隔19~42日間の参加者が含まれ、その内訳はVE1とVE2でそれぞれ19
~23日間の参加者は96.2%(40515例)と96.1%(42739例)、24~42日間の参加者は3.8%(1579
例)と3.9%(1747例)であった4)
プラセボ接種群
3回目接種後1ヵ月
2回目接種後1ヵ月
2476.4[2210.1,2774.9]
753.7[658.2,863.1]
3.29[2.76,3.91]
測定例数
210
注射部位疼痛
疲労
頭痛
筋肉痛
悪寒
関節痛
発熱b)
事象全体
240(83.0)
1(0.3)
疲労
3
289
184(63.7)
13(4.5)
Grade 3以上b)
頭痛
3
289
140(48.4)
3(1.0)
筋肉痛
3
289
113(39.1)
4(1.4)
悪寒
3
289
84(29.1)
3(1.0)
関節痛
3
289
73(25.3)
1(0.3)
発熱c)
3
289
25(8.7)
1(0.3)
リンパ節症d)
3
306
16(5.2)
1(0.3)
365.6[254.6, 525.0]
36.6[25.5, 52.5]
全年齢
40
10.6[9.8, 11.4]
1.1[1.0, 1.1]
プラセボ接種群
接種回数
事象全体
Grade 3以上a)
事象全体
Grade 3以上a)
1
103(86.6)
2(1.7)
1(2.4)
0(-)
2
92(79.3)
2(1.7)
0(-)
0(-)
1
48(40.3)
1(0.8)
4(9.8)
0(-)
2
70(60.3)
4(3.4)
1(2.4)
0(-)
1
39(32.8)
1(0.8)
6(14.6)
0(-)
2
51(44.0)
2(1.7)
5(12.2)
0(-)
1
17(14.3)
0(-)
1(2.4)
0(-)
2
19(16.4)
0(-)
0(-)
0(-)
1
30(25.2)
1(0.8)
2(4.9)
0(-)
2
53(45.7)
2(1.7)
1(2.4)
0(-)
1
17(14.3)
1(0.8)
2(4.9)
0(-)
2
29(25.0)
1(0.9)
0(-)
0(-)
1
17(14.3)
0(-)
0(-)
0(-)
2
38(32.8)
1(0.9)
0(-)
0(-)
18. 薬効薬理
18.1 作用機序
本剤に含有される修飾ウリジンメッセンジャーRNA(mRNA)は脂質ナ
ノ粒子に封入されており、それにより非複製性であるmRNAが宿主細
胞に取り込まれ、mRNAにコードされるSARS-CoV-2のスパイクタンパ
ク質が一過性に発現する。本剤接種によりスパイクタンパク質に対
する中和抗体産生及び細胞性免疫応答が誘導されることで、SARSCoV-2による感染症の予防に寄与すると考えられている。
本剤接種群
289
22
a)重症度が「高度(日常活動を妨げる)」以上として報告された事象
b)37.5℃以上。38.9℃を超えた場合に、重症度が高度(Grade 3)以上とした
発現例数(発現割合[%])
評価例数a)
55.8[48.7, 63.9]
65~85歳
発現例数(発現割合[%])
表8 主な副反応の発現状況(本剤3回目接種後)
3
51.5[45.2, 58.7]
570.7[497.6, 654.5]
本剤接種群
18~55歳の参加者306例を対象に本剤3回目接種後の安全性を評価し
た。治験薬接種後7日間、電子日誌により副反応の発現状況を評価し
た。主な副反応の発現状況(事象全体及びGrade 3以上)は表8のと
おりであった。注射部位疼痛は接種当日(中央値)に発現し、持続
期間は2日(中央値)であった。その他のリンパ節症を除く全身性の
事象は接種翌日(中央値)に発現し、持続期間は1~2日(中央値)
であった。リンパ節症は接種当日~4日目に発現し、大部分が5日以
内に回復した5)。
接種回数
524.5[459.7, 598.4]
94
表10 主な副反応の発現状況
GMR:幾何平均比、GMT:幾何平均抗体価
a)抗体価が定量下限(LLOQ)未満の場合、解析には0.5×LLOQの値が用いられた
b)非劣性の成功基準:GMR(3回目接種後1ヵ月/2回目接種後1ヵ月)の両側97.5%信頼区間下
限>0.67及びGMR点推定値≥0.8
注射部位疼痛
116
20~64歳
160例(本剤接種群:119例、プラセボ接種群:41例)を対象に本剤
接種後の安全性を評価した。治験薬接種後7日間は電子日誌により副
反応が収集され、主な副反応の発現状況(事象全体及びGrade 3以上)
は表10のとおりであった。注射部位疼痛は接種当日から翌日(中央
値)の間に発現し、持続期間は2日(中央値)であった。その他の全
身性の事象は接種翌日(中央値)に発現し、持続期間は1日(中央値)
であった6)。
表7 3回目接種後1ヵ月の2回目接種後1ヵ月に対するSARS-CoV-2血清中
和抗体価(50%中和抗体価)の幾何平均比
GMR[両側97.5%信頼
区間]b)
全年齢
GMFR:幾何平均上昇倍率、GMT:幾何平均抗体価
a)抗体価が定量下限(LLOQ)未満の場合、解析には0.5×LLOQの値が用いられた
(4)追加免疫(本剤3回目接種)
本試験で本剤30µgを2回接種済みの18~55歳の参加者306例に、2回目
接種から5~7ヵ月後に本剤30µgを1回接種したときの安全性及び免
疫原性を検討した。
SARS-CoV-2感染歴がない210例を対象に、本剤3回目接種後1ヵ月の
SARS-CoV-2血清中和抗体価を評価した結果、表7のとおり本剤2回目
接種後1ヵ月のSARS-CoV-2血清中和抗体価に対する非劣性が示され
た。
GMT[両側95%信頼区間]a)
GMFR[両側95%信頼区間]a)
GMT[両側95%信頼区間]a)
(2回目接種後1ヵ月/1回
(2回目接種後1ヵ月)
目接種前)
21. 承認条件
21.1 医薬品リスク管理計画を策定の上、適切に実施すること。
21.2 現時点での知見が限られていることから、製造販売後、副作用情
報等の本剤の安全性に関するデータを、あらかじめ定めた計画に基
づき早期に収集するとともに、独立行政法人医薬品医療機器総合機
構に提出し、本剤の適正使用に必要な措置を講じること。その際、
国が実施する健康調査等により得られた情報についても適切に反映
すること。
a)電子日誌により評価した例数(リンパ節症を除く)
b)重症度が「高度(日常活動を妨げる)」以上として報告された事象
c)38.0℃以上。38.9℃を超えた場合に、重症度が高度(Grade 3)以上とした
d)
「重度(試験参加者の通常の機能を顕著に妨げる)」以上の場合に、重症度が高度(Grade 3)
以上とした
4
SARS-CoV-2ワクチン未接種の20歳以上85歳以下の日本人健康成人を
対象に、本剤30µgを19~23日間隔で2回接種したときの安全性、忍容
性及び免疫原性を検討することを目的として、プラセボ対照試験を
実施した。
156例(本剤接種群:116例、プラセボ接種群:40例)を対象に免疫
原性を評価し、2回目接種後1ヵ月のSARS-CoV-2血清中和抗体価は表
9のとおりであった。
(3)フォローアップ解析(12歳以上の参加者、2021年3月13日データカ
ットオフ)
42094例(本剤接種群:20998例、プラセボ接種群:21096例)及び44486
例(本剤接種群:22166例、プラセボ接種群:22320例)を対象にそ
れぞれVE1及びVE2のフォローアップ解析を行った。解析結果は表6の
とおりであった4)。
表6 SARS-CoV-2による感染症に対する有効性(2021年3月13日データカ
ットオフ)
SARS-CoV-2
による感染症
確定例数
解析対象例数
VE1a)
VE2a)
本剤接種群
20998
77
プラセボ接種群
21096
850
本剤接種群
22166
81
プラセボ接種群
22320
873
表9 2回目接種後1ヵ月のSARS-CoV-2血清中和抗体価(50%中和抗体価)
ワクチン有効性
[95%信頼区間](%)
測定
例数
91.3[89.0, 93.2]
本剤接種群
91.1[88.8, 93.0]
a)VE1及びVE2の2回目接種後の追跡期間(中央値)はいずれも118日であった。また、VE1及び
VE2の解析には接種間隔19~42日間の参加者が含まれ、その内訳はVE1とVE2でそれぞれ19
~23日間の参加者は96.2%(40515例)と96.1%(42739例)、24~42日間の参加者は3.8%(1579
例)と3.9%(1747例)であった4)
プラセボ接種群
3回目接種後1ヵ月
2回目接種後1ヵ月
2476.4[2210.1,2774.9]
753.7[658.2,863.1]
3.29[2.76,3.91]
測定例数
210
注射部位疼痛
疲労
頭痛
筋肉痛
悪寒
関節痛
発熱b)
事象全体
240(83.0)
1(0.3)
疲労
3
289
184(63.7)
13(4.5)
Grade 3以上b)
頭痛
3
289
140(48.4)
3(1.0)
筋肉痛
3
289
113(39.1)
4(1.4)
悪寒
3
289
84(29.1)
3(1.0)
関節痛
3
289
73(25.3)
1(0.3)
発熱c)
3
289
25(8.7)
1(0.3)
リンパ節症d)
3
306
16(5.2)
1(0.3)
365.6[254.6, 525.0]
36.6[25.5, 52.5]
全年齢
40
10.6[9.8, 11.4]
1.1[1.0, 1.1]
プラセボ接種群
接種回数
事象全体
Grade 3以上a)
事象全体
Grade 3以上a)
1
103(86.6)
2(1.7)
1(2.4)
0(-)
2
92(79.3)
2(1.7)
0(-)
0(-)
1
48(40.3)
1(0.8)
4(9.8)
0(-)
2
70(60.3)
4(3.4)
1(2.4)
0(-)
1
39(32.8)
1(0.8)
6(14.6)
0(-)
2
51(44.0)
2(1.7)
5(12.2)
0(-)
1
17(14.3)
0(-)
1(2.4)
0(-)
2
19(16.4)
0(-)
0(-)
0(-)
1
30(25.2)
1(0.8)
2(4.9)
0(-)
2
53(45.7)
2(1.7)
1(2.4)
0(-)
1
17(14.3)
1(0.8)
2(4.9)
0(-)
2
29(25.0)
1(0.9)
0(-)
0(-)
1
17(14.3)
0(-)
0(-)
0(-)
2
38(32.8)
1(0.9)
0(-)
0(-)
18. 薬効薬理
18.1 作用機序
本剤に含有される修飾ウリジンメッセンジャーRNA(mRNA)は脂質ナ
ノ粒子に封入されており、それにより非複製性であるmRNAが宿主細
胞に取り込まれ、mRNAにコードされるSARS-CoV-2のスパイクタンパ
ク質が一過性に発現する。本剤接種によりスパイクタンパク質に対
する中和抗体産生及び細胞性免疫応答が誘導されることで、SARSCoV-2による感染症の予防に寄与すると考えられている。
本剤接種群
289
22
a)重症度が「高度(日常活動を妨げる)」以上として報告された事象
b)37.5℃以上。38.9℃を超えた場合に、重症度が高度(Grade 3)以上とした
発現例数(発現割合[%])
評価例数a)
55.8[48.7, 63.9]
65~85歳
発現例数(発現割合[%])
表8 主な副反応の発現状況(本剤3回目接種後)
3
51.5[45.2, 58.7]
570.7[497.6, 654.5]
本剤接種群
18~55歳の参加者306例を対象に本剤3回目接種後の安全性を評価し
た。治験薬接種後7日間、電子日誌により副反応の発現状況を評価し
た。主な副反応の発現状況(事象全体及びGrade 3以上)は表8のと
おりであった。注射部位疼痛は接種当日(中央値)に発現し、持続
期間は2日(中央値)であった。その他のリンパ節症を除く全身性の
事象は接種翌日(中央値)に発現し、持続期間は1~2日(中央値)
であった。リンパ節症は接種当日~4日目に発現し、大部分が5日以
内に回復した5)。
接種回数
524.5[459.7, 598.4]
94
表10 主な副反応の発現状況
GMR:幾何平均比、GMT:幾何平均抗体価
a)抗体価が定量下限(LLOQ)未満の場合、解析には0.5×LLOQの値が用いられた
b)非劣性の成功基準:GMR(3回目接種後1ヵ月/2回目接種後1ヵ月)の両側97.5%信頼区間下
限>0.67及びGMR点推定値≥0.8
注射部位疼痛
116
20~64歳
160例(本剤接種群:119例、プラセボ接種群:41例)を対象に本剤
接種後の安全性を評価した。治験薬接種後7日間は電子日誌により副
反応が収集され、主な副反応の発現状況(事象全体及びGrade 3以上)
は表10のとおりであった。注射部位疼痛は接種当日から翌日(中央
値)の間に発現し、持続期間は2日(中央値)であった。その他の全
身性の事象は接種翌日(中央値)に発現し、持続期間は1日(中央値)
であった6)。
表7 3回目接種後1ヵ月の2回目接種後1ヵ月に対するSARS-CoV-2血清中
和抗体価(50%中和抗体価)の幾何平均比
GMR[両側97.5%信頼
区間]b)
全年齢
GMFR:幾何平均上昇倍率、GMT:幾何平均抗体価
a)抗体価が定量下限(LLOQ)未満の場合、解析には0.5×LLOQの値が用いられた
(4)追加免疫(本剤3回目接種)
本試験で本剤30µgを2回接種済みの18~55歳の参加者306例に、2回目
接種から5~7ヵ月後に本剤30µgを1回接種したときの安全性及び免
疫原性を検討した。
SARS-CoV-2感染歴がない210例を対象に、本剤3回目接種後1ヵ月の
SARS-CoV-2血清中和抗体価を評価した結果、表7のとおり本剤2回目
接種後1ヵ月のSARS-CoV-2血清中和抗体価に対する非劣性が示され
た。
GMT[両側95%信頼区間]a)
GMFR[両側95%信頼区間]a)
GMT[両側95%信頼区間]a)
(2回目接種後1ヵ月/1回
(2回目接種後1ヵ月)
目接種前)
21. 承認条件
21.1 医薬品リスク管理計画を策定の上、適切に実施すること。
21.2 現時点での知見が限られていることから、製造販売後、副作用情
報等の本剤の安全性に関するデータを、あらかじめ定めた計画に基
づき早期に収集するとともに、独立行政法人医薬品医療機器総合機
構に提出し、本剤の適正使用に必要な措置を講じること。その際、
国が実施する健康調査等により得られた情報についても適切に反映
すること。
a)電子日誌により評価した例数(リンパ節症を除く)
b)重症度が「高度(日常活動を妨げる)」以上として報告された事象
c)38.0℃以上。38.9℃を超えた場合に、重症度が高度(Grade 3)以上とした
d)
「重度(試験参加者の通常の機能を顕著に妨げる)」以上の場合に、重症度が高度(Grade 3)
以上とした
4