よむ、つかう、まなぶ。
別紙4○新規技術(11月受理分)の先進医療A又は先進医療Bへの振り分けについて(案) (6 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000205617_00052.html |
| 出典情報 | 先進医療会議(第116回 11/10)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
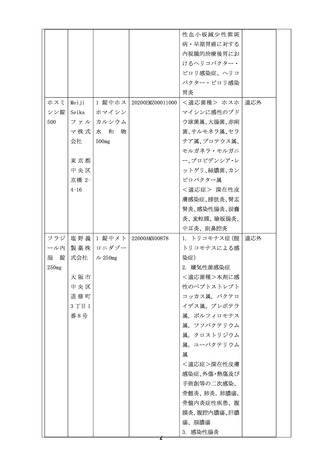
品目名
製造販売業
者名及び連
絡先
規
格
医薬品医療
機器法承認
又は
認証番号
(16桁)
医薬品医療機器法承認
又は
認証上の適応
(注1)
医薬品医療
機器法上の
適応外使用
の該当
(注2)
該当なし
④医療機器、医療材料、医薬品又は再生医療等製品が医薬品医療機器法上の適応外使用に該当
する場合の医薬品医療機器法承認一部変更申請状況
医療機器名又は品目名
医薬品医療機器法承認一部変更申請状況
該当なし
⑤医療機器、医療材料、医薬品又は再生医療等製品が医薬品医療機器法上の未承認又は適応外
使用に該当する場合の使用方法等
AFM 療法(抗菌薬である Amoxicillin、Fosfomycin、Metronidazole の 3 剤併用療法)と
して、アモキシシリン水和物 1,500 mg、ホスホマイシンカルシウム水和物 3,000 mg、
メトロニダゾール 750 mg をそれぞれ 3 回/日に分割し、2 週間経口投与する。AFM 療法
(抗菌薬投与)完了 2~7 日後に、大腸内視鏡による腸内細菌叢移植(FMT)を施行(腸
内細菌叢溶液 200mL)。大腸内視鏡による FMT 実施 1 週間後および 2 週間後に、注腸 FMT
を施行(腸内細菌叢溶液 100mL)
。
⑥未承認又は適応外の場合は、□にレと記載する。
☑
当該医薬品・医療機器・再生医療等製品について、薬事承認の申請時及び
取得時において、申請企業から情報提供がなされることとなっている。
注1)医薬品医療機器法承認又は認証上の使用目的、効能及び効果を記入すること。
注2)医薬品医療機器法において適応外使用に該当する場合は「適応外」
、医薬品医療機器法で承認された適応
の範囲内の使用の場合は「適応内」と記載すること。
2-2.海外での承認に関する情報
A-FMT 療法に関して
□薬事承認:米国(無)、欧州(無)
□ガイドライン記載:(無)
□進行中の臨床試験:(無)
(参考)FMT に関して
□薬事承認:米国(無)、欧州(無)、豪州(有)
世界で統一された薬事承認が無いのが現状であるが、FMT に関して先進的なオーストラリアの
規制当局は、FMT 製品を Biologicals(生物由来製品カテゴリ)として分類し、FMT のための溶液
の製造に関して、複数の事業者を承認している。
□ガイドライン記載:(無)
潰瘍性大腸炎に対してはガイドライン化されていない。
□進行中の臨床試験:
6
製造販売業
者名及び連
絡先
規
格
医薬品医療
機器法承認
又は
認証番号
(16桁)
医薬品医療機器法承認
又は
認証上の適応
(注1)
医薬品医療
機器法上の
適応外使用
の該当
(注2)
該当なし
④医療機器、医療材料、医薬品又は再生医療等製品が医薬品医療機器法上の適応外使用に該当
する場合の医薬品医療機器法承認一部変更申請状況
医療機器名又は品目名
医薬品医療機器法承認一部変更申請状況
該当なし
⑤医療機器、医療材料、医薬品又は再生医療等製品が医薬品医療機器法上の未承認又は適応外
使用に該当する場合の使用方法等
AFM 療法(抗菌薬である Amoxicillin、Fosfomycin、Metronidazole の 3 剤併用療法)と
して、アモキシシリン水和物 1,500 mg、ホスホマイシンカルシウム水和物 3,000 mg、
メトロニダゾール 750 mg をそれぞれ 3 回/日に分割し、2 週間経口投与する。AFM 療法
(抗菌薬投与)完了 2~7 日後に、大腸内視鏡による腸内細菌叢移植(FMT)を施行(腸
内細菌叢溶液 200mL)。大腸内視鏡による FMT 実施 1 週間後および 2 週間後に、注腸 FMT
を施行(腸内細菌叢溶液 100mL)
。
⑥未承認又は適応外の場合は、□にレと記載する。
☑
当該医薬品・医療機器・再生医療等製品について、薬事承認の申請時及び
取得時において、申請企業から情報提供がなされることとなっている。
注1)医薬品医療機器法承認又は認証上の使用目的、効能及び効果を記入すること。
注2)医薬品医療機器法において適応外使用に該当する場合は「適応外」
、医薬品医療機器法で承認された適応
の範囲内の使用の場合は「適応内」と記載すること。
2-2.海外での承認に関する情報
A-FMT 療法に関して
□薬事承認:米国(無)、欧州(無)
□ガイドライン記載:(無)
□進行中の臨床試験:(無)
(参考)FMT に関して
□薬事承認:米国(無)、欧州(無)、豪州(有)
世界で統一された薬事承認が無いのが現状であるが、FMT に関して先進的なオーストラリアの
規制当局は、FMT 製品を Biologicals(生物由来製品カテゴリ)として分類し、FMT のための溶液
の製造に関して、複数の事業者を承認している。
□ガイドライン記載:(無)
潰瘍性大腸炎に対してはガイドライン化されていない。
□進行中の臨床試験:
6