よむ、つかう、まなぶ。
資料4-3 要指導医薬品のリスク評価(フルチカゾンプロピオン酸エステル) (5 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_29460.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会(令和4年度第3回 12/1)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
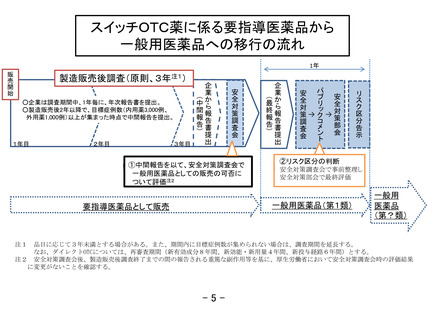
スイッチOTC薬に係る要指導医薬品から
一般用医薬品への移行の流れ
1年
販
売
開
始
製造販売後調査(原則、3年注1)
①中間報告を以て、安全対策調査会で
一般用医薬品としての販売の可否に
ついて評価注2
企
業
(
最か
ら
終報
報告
告書
)提
出
安
全
対
策
調
査
会
パ
ブ
リ
ッ
ク
コ
メ
ン
ト
↑
安
全
対
策
調
査
会
↑
企
業
(
○企業は調査期間中、1年毎に、年次報告書を提出。
中か
ら
○製造販売後2年以降で、目標症例数(内用薬3,000例、
間報
外用薬1,000例)以上が集まった時点で中間報告を提出。
報告
告書
)提
出
1年目
2年目
3年目
安
全
対
策
部
会
②リスク区分の判断
安全対策調査会で事前整理し
安全対策部会で最終評価
一般用医薬品(第1類)
要指導医薬品として販売
リ
ス
ク
区
分
告
示
一般用
医薬品
(第?類)
注1 品目に応じて3年未満とする場合がある。また、期間内に目標症例数が集められない場合は、調査期間を延長する。
なお、ダイレクトOTCについては、再審査期間(新有効成分8年間、新効能・新用量4年間、新投与経路6年間)とする。
注2 安全対策調査会後、製造販売後調査終了までの間の報告される重篤な副作用等を基に、厚生労働省において安全対策調査会時の評価結果
に変更がないことを確認する。
-5-
一般用医薬品への移行の流れ
1年
販
売
開
始
製造販売後調査(原則、3年注1)
①中間報告を以て、安全対策調査会で
一般用医薬品としての販売の可否に
ついて評価注2
企
業
(
最か
ら
終報
報告
告書
)提
出
安
全
対
策
調
査
会
パ
ブ
リ
ッ
ク
コ
メ
ン
ト
↑
安
全
対
策
調
査
会
↑
企
業
(
○企業は調査期間中、1年毎に、年次報告書を提出。
中か
ら
○製造販売後2年以降で、目標症例数(内用薬3,000例、
間報
外用薬1,000例)以上が集まった時点で中間報告を提出。
報告
告書
)提
出
1年目
2年目
3年目
安
全
対
策
部
会
②リスク区分の判断
安全対策調査会で事前整理し
安全対策部会で最終評価
一般用医薬品(第1類)
要指導医薬品として販売
リ
ス
ク
区
分
告
示
一般用
医薬品
(第?類)
注1 品目に応じて3年未満とする場合がある。また、期間内に目標症例数が集められない場合は、調査期間を延長する。
なお、ダイレクトOTCについては、再審査期間(新有効成分8年間、新効能・新用量4年間、新投与経路6年間)とする。
注2 安全対策調査会後、製造販売後調査終了までの間の報告される重篤な副作用等を基に、厚生労働省において安全対策調査会時の評価結果
に変更がないことを確認する。
-5-