よむ、つかう、まなぶ。
資 料 2-1 血液製剤に関する医療機関からの感染症報告事例等について (5 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_30905.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会血液事業部会運営委員会(令和4年度第4回 2/7)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
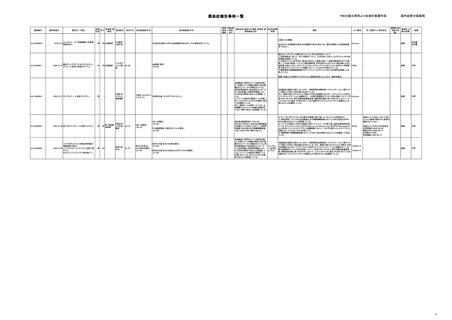
感染症報告事例一覧
識別番号
報告受領日
販売名(一般名)
患者
原疾患(簡
年代
感染症名
性別
略名)
投与年月
投与前検査(年月)
投与後検査(年月)
PMDA提出資料より血液対策課作成
患者 受血者
原料血漿・製品NAT検査(再検査・製 併用血液製
検体 個別
造時検査の別)
剤等
確保 NAT
備考
ロット番号
同一製剤ロット使用状況
国内血漿分画製剤
重篤性(担
重篤性(企
当医の見
業の見解)
解)
転帰
文献からの情報。
AA-22000029
AA-22000031
コンコエイト-HT(乾燥濃縮人血液凝
2022/9/2
固第8因子)
2022/9/16
献血ヴェノグロブリンIH(ポリエチレン
グリコール処理人免疫グロブリン)
男
女
60 血液疾患
50 血液疾患
HIV感染
C型肝炎
パルボウ
イルス感
染
-
22/08
-
-
先天性血友病Aに対する血液製剤由来のHIV、HCV感染を有していた。
IgM検査 陰性。
(22/09)
-
-
-
-
-
-
-
-
投与された血液製剤は過去の血液製剤であると考えられ、現在の製剤による感染症報
告ではない。
Unknown
献血ヴェノグロブリンIH静注のウイルスに対する安全性について
1) 原料供給元において、全ての献血について、CLEIA法によるヒトパルボウイルスB19抗
原検査を実施している。
2) 本剤はウイルスの不活化・除去を目的として製造工程に(1.液状加熱処理(60℃10時
間)、2. 8%PEG処理、3.ウイルス除去膜処理(平均孔径19nmのウイルス除去膜によるろ
過処理)を施しており、モデルウイルスとしてCPV(イヌパルボウイルス)を用いた本剤製 F095J
造工程のウイルスクリアランス試験において、13.5のLRVが得られている。
3) 最終製剤の核酸増幅試験(NAT)にてヒトパルボウイルスB19 DNA陰性を確認して出
荷している。
-
-
重篤
未回復
未回復
-
-
重篤
不明
-
-
重篤
不明
当該ロット(2F263)の出荷状況
出荷開始日:2020/08/04
最終出荷日:2020/09/17
出荷数:16,705本
有効期限: 2022/03/15
-
重篤
不明
-
-
重篤
不明
医師・企業ともに患者のパルボウイルス感染を否定したことから、報告対象外。
AA-22000034
AA-22000035
AA-22000036
2022/9/21 アルブミナー(人血清アルブミン)
2022/9/22 赤十字アルブミン(人血清アルブミン)
フィブロガミンP(ヒト血漿由来乾燥血
液凝固第13因子)
2022/9/28 べリプラストP(フィブリノゲン加第13因
子(2))
タココンブ(フィブリノゲン配合剤(1))
男
男
男
--
C型肝炎
ウイルス 検査陽性
B型肝炎
腎・泌尿器
80
コア抗体
系疾患
陽性
60 -
急性C型
肝炎
20/10
不明日 HCVはマイ
本剤投与後、HCVがプラスになった。
ナスだった。
HBc-Ab陰性。
(20/10)
-
当該製品に使用されている原料血漿
は、各種ウイルス検査が陰性である登
録されたドナーから採取されている。
原料血漿供給元である採血センターで
は、供血者毎に血清学的検査により
HCV抗体が陰性であることを確認して
いる。
ミニプール血漿及び製造プール血漿に
おいては、NATによりHCVが陰性である
ことを確認している。
また、製造プール血漿については、公
的機関によるウイルス検査も実施され
ており、陰性であることを確認している。
当該製品の製造工程中には、60℃、10時間液状加熱処理(パスツリゼーション)等のウイ
ルス除去・不活化工程が組み込まれている。
また、製造工程におけるウイルス除去・不活化を確認するために、モデルウイルスを用い
たウイルスバリデーション試験を行い、「血漿分画製剤のウイルス安全対策について」(平 Unknown
成15年11月7日付 厚生労働省医薬食品局 4課長連名通知 第1107001号)において、ウ
イルスが十分に除去・不活化されていると判断されたウイルスクリアランス指数9以上が
得られることを確認している。
-
原血漿(製造番号BC-4831,BC4833,BC-4834,BC-4836)及び最終製品
の当該ロット(2F263)において、血清学 的検査(HBs抗原)及び核酸増幅検査
(HBV-DNA)は全て陰性であった。
以下に、赤十字アルブミン25%静注の製造工程に施しているウイルス対策を示す。
(1) 原料血漿についてHBs抗原検査および核酸増幅試験(NAT)にてHBV抗原及びHBVDNAが検出されないことを確認している。
(2) ウイルスの除去・不活化の製造工程としてアルコール分画工程、液状加熱処理を施し
ている。モデルウイルスとしてBVDV(Bovine viral diarrhea virus)及びPRV(Pseudorabies 2F263
virus)を用いたウイルスクリアランス試験結果において、それぞれ総ウイルスクリアランス
指数≧9.6、≧10.9というLRVを得ている。
(3) 最終製剤で核酸増幅試験(NAT)にてHBV–DNAが検出されないことを確認して出荷し
ている。
-
当該製品に使用されている原料血漿
は、各種ウイルス検査が陰性である登
録されたドナーから採取されている。原
料血漿供給元である採血センターで
アルブミン
は、供血者毎に血清学的検査により
(人血清ア
HCV抗体が陰性であることを確認して ルブミン)
いる。ミニプール血漿及び製造プール
血漿においては、NATによりHCVが陰
性であることを確認している。
当該製品の製造工程中には、60℃、10時間液状加熱処理(パスツリゼーション)等のウイ
ルス除去・不活化工程が組み込まれている。また、製造工程におけるウイルス除去・不活
14764211A
化を確認するために、モデルウイルスを用いたウイルスバリデーション試験を行い、「血
、
漿分画製剤のウイルス安全対策について」(平成15年11月7日付 厚生労働省医薬食品
15164211A
局 4課長連名通知 第1107001号)において、ウイルスが十分に除去・不活化されていると
判断されたウイルスクリアランス指数9以上が得られることを確認している。
-
HBc-Ab陽性。
(22/09)
PCR検査実施。B型肝炎ウイルス陰性。
(22/09)
投与51日後 抗HCV抗体は陰性。
(01/09)
01/07
投与19日前 抗
HCV抗体は陰性。
(01/07)
投与56日後 抗HCV抗体およびHCV-PCRは陽性。
(01/09)
-
当該ロット(2F263)において他に
ウイルス感染が疑われた症例は
報告されていない。
4
識別番号
報告受領日
販売名(一般名)
患者
原疾患(簡
年代
感染症名
性別
略名)
投与年月
投与前検査(年月)
投与後検査(年月)
PMDA提出資料より血液対策課作成
患者 受血者
原料血漿・製品NAT検査(再検査・製 併用血液製
検体 個別
造時検査の別)
剤等
確保 NAT
備考
ロット番号
同一製剤ロット使用状況
国内血漿分画製剤
重篤性(担
重篤性(企
当医の見
業の見解)
解)
転帰
文献からの情報。
AA-22000029
AA-22000031
コンコエイト-HT(乾燥濃縮人血液凝
2022/9/2
固第8因子)
2022/9/16
献血ヴェノグロブリンIH(ポリエチレン
グリコール処理人免疫グロブリン)
男
女
60 血液疾患
50 血液疾患
HIV感染
C型肝炎
パルボウ
イルス感
染
-
22/08
-
-
先天性血友病Aに対する血液製剤由来のHIV、HCV感染を有していた。
IgM検査 陰性。
(22/09)
-
-
-
-
-
-
-
-
投与された血液製剤は過去の血液製剤であると考えられ、現在の製剤による感染症報
告ではない。
Unknown
献血ヴェノグロブリンIH静注のウイルスに対する安全性について
1) 原料供給元において、全ての献血について、CLEIA法によるヒトパルボウイルスB19抗
原検査を実施している。
2) 本剤はウイルスの不活化・除去を目的として製造工程に(1.液状加熱処理(60℃10時
間)、2. 8%PEG処理、3.ウイルス除去膜処理(平均孔径19nmのウイルス除去膜によるろ
過処理)を施しており、モデルウイルスとしてCPV(イヌパルボウイルス)を用いた本剤製 F095J
造工程のウイルスクリアランス試験において、13.5のLRVが得られている。
3) 最終製剤の核酸増幅試験(NAT)にてヒトパルボウイルスB19 DNA陰性を確認して出
荷している。
-
-
重篤
未回復
未回復
-
-
重篤
不明
-
-
重篤
不明
当該ロット(2F263)の出荷状況
出荷開始日:2020/08/04
最終出荷日:2020/09/17
出荷数:16,705本
有効期限: 2022/03/15
-
重篤
不明
-
-
重篤
不明
医師・企業ともに患者のパルボウイルス感染を否定したことから、報告対象外。
AA-22000034
AA-22000035
AA-22000036
2022/9/21 アルブミナー(人血清アルブミン)
2022/9/22 赤十字アルブミン(人血清アルブミン)
フィブロガミンP(ヒト血漿由来乾燥血
液凝固第13因子)
2022/9/28 べリプラストP(フィブリノゲン加第13因
子(2))
タココンブ(フィブリノゲン配合剤(1))
男
男
男
--
C型肝炎
ウイルス 検査陽性
B型肝炎
腎・泌尿器
80
コア抗体
系疾患
陽性
60 -
急性C型
肝炎
20/10
不明日 HCVはマイ
本剤投与後、HCVがプラスになった。
ナスだった。
HBc-Ab陰性。
(20/10)
-
当該製品に使用されている原料血漿
は、各種ウイルス検査が陰性である登
録されたドナーから採取されている。
原料血漿供給元である採血センターで
は、供血者毎に血清学的検査により
HCV抗体が陰性であることを確認して
いる。
ミニプール血漿及び製造プール血漿に
おいては、NATによりHCVが陰性である
ことを確認している。
また、製造プール血漿については、公
的機関によるウイルス検査も実施され
ており、陰性であることを確認している。
当該製品の製造工程中には、60℃、10時間液状加熱処理(パスツリゼーション)等のウイ
ルス除去・不活化工程が組み込まれている。
また、製造工程におけるウイルス除去・不活化を確認するために、モデルウイルスを用い
たウイルスバリデーション試験を行い、「血漿分画製剤のウイルス安全対策について」(平 Unknown
成15年11月7日付 厚生労働省医薬食品局 4課長連名通知 第1107001号)において、ウ
イルスが十分に除去・不活化されていると判断されたウイルスクリアランス指数9以上が
得られることを確認している。
-
原血漿(製造番号BC-4831,BC4833,BC-4834,BC-4836)及び最終製品
の当該ロット(2F263)において、血清学 的検査(HBs抗原)及び核酸増幅検査
(HBV-DNA)は全て陰性であった。
以下に、赤十字アルブミン25%静注の製造工程に施しているウイルス対策を示す。
(1) 原料血漿についてHBs抗原検査および核酸増幅試験(NAT)にてHBV抗原及びHBVDNAが検出されないことを確認している。
(2) ウイルスの除去・不活化の製造工程としてアルコール分画工程、液状加熱処理を施し
ている。モデルウイルスとしてBVDV(Bovine viral diarrhea virus)及びPRV(Pseudorabies 2F263
virus)を用いたウイルスクリアランス試験結果において、それぞれ総ウイルスクリアランス
指数≧9.6、≧10.9というLRVを得ている。
(3) 最終製剤で核酸増幅試験(NAT)にてHBV–DNAが検出されないことを確認して出荷し
ている。
-
当該製品に使用されている原料血漿
は、各種ウイルス検査が陰性である登
録されたドナーから採取されている。原
料血漿供給元である採血センターで
アルブミン
は、供血者毎に血清学的検査により
(人血清ア
HCV抗体が陰性であることを確認して ルブミン)
いる。ミニプール血漿及び製造プール
血漿においては、NATによりHCVが陰
性であることを確認している。
当該製品の製造工程中には、60℃、10時間液状加熱処理(パスツリゼーション)等のウイ
ルス除去・不活化工程が組み込まれている。また、製造工程におけるウイルス除去・不活
14764211A
化を確認するために、モデルウイルスを用いたウイルスバリデーション試験を行い、「血
、
漿分画製剤のウイルス安全対策について」(平成15年11月7日付 厚生労働省医薬食品
15164211A
局 4課長連名通知 第1107001号)において、ウイルスが十分に除去・不活化されていると
判断されたウイルスクリアランス指数9以上が得られることを確認している。
-
HBc-Ab陽性。
(22/09)
PCR検査実施。B型肝炎ウイルス陰性。
(22/09)
投与51日後 抗HCV抗体は陰性。
(01/09)
01/07
投与19日前 抗
HCV抗体は陰性。
(01/07)
投与56日後 抗HCV抗体およびHCV-PCRは陽性。
(01/09)
-
当該ロット(2F263)において他に
ウイルス感染が疑われた症例は
報告されていない。
4