よむ、つかう、まなぶ。
総-9○患者申出療養評価会議からの報告について (5 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000212500_00177.html |
| 出典情報 | 中央社会保険医療協議会 総会(第540回 3/8)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
EZH2阻害薬の有効性が期待される標準治療がないまたは治療抵抗性の
小児・AYA悪性固形腫瘍に対するタゼメトスタット療法に関する患者申出療養
実施医療機関からの申請資料
(概要図)
<対象>6か月以上29歳以下で標準治療がないまたは治療抵抗性の小児・AYA悪性固形腫瘍患者で、以下のいずれかを満たす
•
•
•
遺伝子パネル検査のエキスパートパネルでタゼメトスタットが推奨されている
免疫染色でINI1またはSMARCA4の発現低下や消失を認める
診断名がラブドイド腫瘍(AT/RT, MRT, RTK)・類上皮肉腫・滑膜肉腫・脊索腫
<目的>タゼメトスタット療法の有効性および安全性を評価する。
<主要評価項目>
<副次評価項目>
投与開始後16週までの最良総合効果に基づく奏効割合
無増悪生存期間、全生存期間、病勢制御割合、有害事象発現割合
<症例登録予定>
症例数見込み:10症例、登録期間:24か月、追跡期間:初回投与から少なくとも2年間
<投与方法と評価スケジュール>
• タゼメトスタットを1日2回、経口内服で投与する。
• 中枢神経腫瘍症例 1200mg/m2/回、非中枢神経腫瘍症例 520mg/m2/回
(ただし18歳以上の非中枢神経腫瘍症例及び22~29歳の中枢神経腫瘍は800mg/回とする。 )
• 安全性評価は、投与開始後16週までは2週間毎、それ以降は1か月毎で実施
• 有効性評価は、投与開始後8週、16週、6か月、1年、1年6か月、2年で実施
安全性評価(2週間毎)
0週
2週
4週
6週
8週
10週
安全性評価(4週間毎)
12週
14週
-5-
有効性評価
16週
6か月
1年
1年6か月
2年
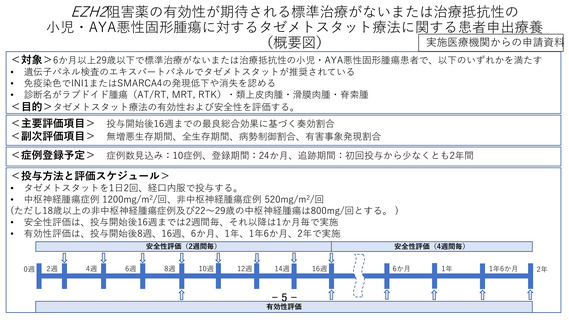
小児・AYA悪性固形腫瘍に対するタゼメトスタット療法に関する患者申出療養
実施医療機関からの申請資料
(概要図)
<対象>6か月以上29歳以下で標準治療がないまたは治療抵抗性の小児・AYA悪性固形腫瘍患者で、以下のいずれかを満たす
•
•
•
遺伝子パネル検査のエキスパートパネルでタゼメトスタットが推奨されている
免疫染色でINI1またはSMARCA4の発現低下や消失を認める
診断名がラブドイド腫瘍(AT/RT, MRT, RTK)・類上皮肉腫・滑膜肉腫・脊索腫
<目的>タゼメトスタット療法の有効性および安全性を評価する。
<主要評価項目>
<副次評価項目>
投与開始後16週までの最良総合効果に基づく奏効割合
無増悪生存期間、全生存期間、病勢制御割合、有害事象発現割合
<症例登録予定>
症例数見込み:10症例、登録期間:24か月、追跡期間:初回投与から少なくとも2年間
<投与方法と評価スケジュール>
• タゼメトスタットを1日2回、経口内服で投与する。
• 中枢神経腫瘍症例 1200mg/m2/回、非中枢神経腫瘍症例 520mg/m2/回
(ただし18歳以上の非中枢神経腫瘍症例及び22~29歳の中枢神経腫瘍は800mg/回とする。 )
• 安全性評価は、投与開始後16週までは2週間毎、それ以降は1か月毎で実施
• 有効性評価は、投与開始後8週、16週、6か月、1年、1年6か月、2年で実施
安全性評価(2週間毎)
0週
2週
4週
6週
8週
10週
安全性評価(4週間毎)
12週
14週
-5-
有効性評価
16週
6か月
1年
1年6か月
2年