よむ、つかう、まなぶ。
総-9○患者申出療養評価会議からの報告について (6 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000212500_00177.html |
| 出典情報 | 中央社会保険医療協議会 総会(第540回 3/8)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
薬事承認までのロードマップ
➢ 現在の日本における
薬事承認状況
効能・効果
再発又は難治性のEZH2遺伝
子変異陽性の濾胞性リンパ
腫(標準的な治療が困難な
場合に限る)
承認年月 2021年6月
➢ 現在の米国における
薬事承認状況
効能・効果
成人または16歳以上の小児
における根治切除不適応の
転移性または局所進行性類
上皮肉腫
承認年月 2020年1月
効能・効果
少なくも2レジメン以上の前
治療歴があり、FDAが承認
したEZH2遺伝子変異の検査
で陽性と診断された成人の
再発・難治性の濾胞性リン
パ腫
承認年月 2020年6月
効能・効果
再発又は難治性の濾胞性リ
ンパ腫(標準的な治療が困
難な場合に限る)
承認年月 2020年6月
実施医療機関からの申請資料
【
国
外
治
験
】
➢ 試験名:EZH-102試験(NCT02601937)(企業治験)
対象:6か月以上18歳未満で再発難治INI1陰性腫瘍(MRT, AT/RT, ラブドイド腫瘍の
特徴を有する腫瘍、その他INI1陰性腫瘍(類上皮肉腫、脊索腫)、SS18-SSX滑膜
肉腫)の症例
デザイン:第1相多施設共同単群非盲検試験
登録症例数:109例(漸増コホート:46例、拡大コホート:63例)
試験期間:2016年1月〜2021年10月(登録終了)
➢ 試験名:APEC1621C試験(NCT03213665)(医師主導研究)
対象:1歳以上21歳未満で、免疫組織化学的にEZH2ホットスポット変異または
SMARCB1もしくはSMARCA4欠損を有する再発難治固形がん、リンパ腫、組織
球性疾患の症例
デザイン:第2相多施設共同単群非盲検試験
登録症例数:20例(登録終了)
試験期間:2017年7月〜2023年4月
【
患
者
申
出
療
養
】
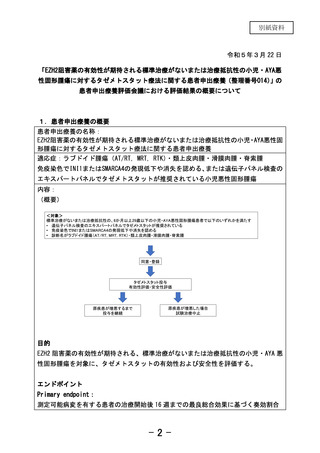
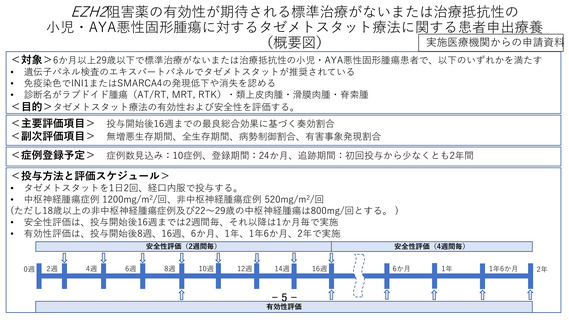
対象: 6か月以上29歳以下で標準治療がないまたは治療抵抗性の小児・AYA悪性固形
腫瘍患者で、以下のいずれかを満たす
• 遺伝子パネル検査のエキスパートパネルでタゼメトスタットが推奨されている
• 免疫染色でINI1またはSMARCA4の発現低下や消失を認める
• 診断名がラブドイド腫瘍(AT/RT, MRT, RTK)、類上皮肉腫、滑膜肉腫、脊索腫
目的:タゼメトスタット療法の有効性および安全性を評価する。
評価項目:投与開始後16週までの最良総合効果、無増悪生存期間、全生存期間、病勢
制御割合、有害事象発現割合
予定登録症例数:10例
予定試験期間:登録期間24か月 追跡期間:初回投与から少なくとも2年間
実施医療機関:国立がん研究センター中央病院
-6-
継続が不適切と考えられた場合
患者申出療養の取り下げ
安国
全外
性小
・児
有・
効成
性人
デで
ーの
タ
有
効
性
や
安
全
性
の
参
考
デ
ー
タ
薬
事
承
認
企
業
治
験
や
医
師
主
導
治
験
の
立
案
・
実
施
➢ 現在の日本における
薬事承認状況
効能・効果
再発又は難治性のEZH2遺伝
子変異陽性の濾胞性リンパ
腫(標準的な治療が困難な
場合に限る)
承認年月 2021年6月
➢ 現在の米国における
薬事承認状況
効能・効果
成人または16歳以上の小児
における根治切除不適応の
転移性または局所進行性類
上皮肉腫
承認年月 2020年1月
効能・効果
少なくも2レジメン以上の前
治療歴があり、FDAが承認
したEZH2遺伝子変異の検査
で陽性と診断された成人の
再発・難治性の濾胞性リン
パ腫
承認年月 2020年6月
効能・効果
再発又は難治性の濾胞性リ
ンパ腫(標準的な治療が困
難な場合に限る)
承認年月 2020年6月
実施医療機関からの申請資料
【
国
外
治
験
】
➢ 試験名:EZH-102試験(NCT02601937)(企業治験)
対象:6か月以上18歳未満で再発難治INI1陰性腫瘍(MRT, AT/RT, ラブドイド腫瘍の
特徴を有する腫瘍、その他INI1陰性腫瘍(類上皮肉腫、脊索腫)、SS18-SSX滑膜
肉腫)の症例
デザイン:第1相多施設共同単群非盲検試験
登録症例数:109例(漸増コホート:46例、拡大コホート:63例)
試験期間:2016年1月〜2021年10月(登録終了)
➢ 試験名:APEC1621C試験(NCT03213665)(医師主導研究)
対象:1歳以上21歳未満で、免疫組織化学的にEZH2ホットスポット変異または
SMARCB1もしくはSMARCA4欠損を有する再発難治固形がん、リンパ腫、組織
球性疾患の症例
デザイン:第2相多施設共同単群非盲検試験
登録症例数:20例(登録終了)
試験期間:2017年7月〜2023年4月
【
患
者
申
出
療
養
】
対象: 6か月以上29歳以下で標準治療がないまたは治療抵抗性の小児・AYA悪性固形
腫瘍患者で、以下のいずれかを満たす
• 遺伝子パネル検査のエキスパートパネルでタゼメトスタットが推奨されている
• 免疫染色でINI1またはSMARCA4の発現低下や消失を認める
• 診断名がラブドイド腫瘍(AT/RT, MRT, RTK)、類上皮肉腫、滑膜肉腫、脊索腫
目的:タゼメトスタット療法の有効性および安全性を評価する。
評価項目:投与開始後16週までの最良総合効果、無増悪生存期間、全生存期間、病勢
制御割合、有害事象発現割合
予定登録症例数:10例
予定試験期間:登録期間24か月 追跡期間:初回投与から少なくとも2年間
実施医療機関:国立がん研究センター中央病院
-6-
継続が不適切と考えられた場合
患者申出療養の取り下げ
安国
全外
性小
・児
有・
効成
性人
デで
ーの
タ
有
効
性
や
安
全
性
の
参
考
デ
ー
タ
薬
事
承
認
企
業
治
験
や
医
師
主
導
治
験
の
立
案
・
実
施