よむ、つかう、まなぶ。
資料3 先進医療Bの試験実施計画の変更について(告示番号19/jRCTs031180008) (2 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_31340.html |
| 出典情報 | 先進医療会議 先進医療技術審査部会(第146回 3/9)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
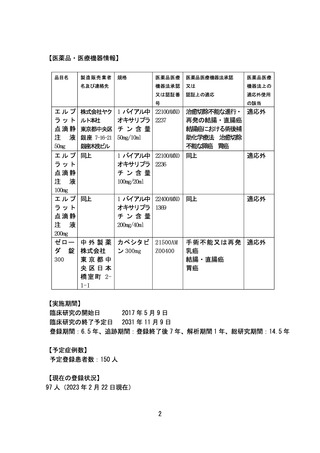
【医薬品・医療機器情報】
品目名
製造販売業者
規格
名及び連絡先
医薬品医療
医薬品医療機器法承認
医薬品医療
機器法承認
又は
機器法上の
又は認証番
認証上の適応
適応外使用
号
エルプ
ラット
点滴静
注 液
50mg
エルプ
ラット
点滴静
注 液
100mg
エルプ
ラット
点滴静
注 液
200mg
ゼロー
ダ 錠
300
株式会社ヤク
ルト本社
東京都中央区
銀座 7-16-21
銀座木挽ビル
同上
同上
の該当
1 バイアル中 22100AMX0 治癒切除不能な進行・ 適応外
オキサリプラ 2237
再発の結腸・直腸癌
チン含量
結腸癌における術後補
50mg/10ml
助化学療法 治癒切除
不能な膵癌 胃癌
1 バイアル中 22100AMX0 同上
適応外
オキサリプラ 2236
チン含量
100mg/20ml
1 バイアル中 22400AMX0 同上
オキサリプラ 1369
チン含量
200mg/40ml
中 外 製 薬 カペシタビ 21500AM
株式会社
ン 300mg
Z00400
東京都中
央区日本
橋 室 町 21-1
適応外
手術不能又は再発 適応外
乳癌
結腸・直腸癌
胃癌
【実施期間】
臨床研究の開始日
2017 年 5 月 9 日
臨床研究の終了予定日 2031 年 11 月 9 日
登録期間:6.5 年、追跡期間:登録終了後 7 年、解析期間 1 年、総研究期間:14.5 年
【予定症例数】
予定登録患者数:150 人
【現在の登録状況】
97 人(2023 年 2 月 22 日現在)
2
品目名
製造販売業者
規格
名及び連絡先
医薬品医療
医薬品医療機器法承認
医薬品医療
機器法承認
又は
機器法上の
又は認証番
認証上の適応
適応外使用
号
エルプ
ラット
点滴静
注 液
50mg
エルプ
ラット
点滴静
注 液
100mg
エルプ
ラット
点滴静
注 液
200mg
ゼロー
ダ 錠
300
株式会社ヤク
ルト本社
東京都中央区
銀座 7-16-21
銀座木挽ビル
同上
同上
の該当
1 バイアル中 22100AMX0 治癒切除不能な進行・ 適応外
オキサリプラ 2237
再発の結腸・直腸癌
チン含量
結腸癌における術後補
50mg/10ml
助化学療法 治癒切除
不能な膵癌 胃癌
1 バイアル中 22100AMX0 同上
適応外
オキサリプラ 2236
チン含量
100mg/20ml
1 バイアル中 22400AMX0 同上
オキサリプラ 1369
チン含量
200mg/40ml
中 外 製 薬 カペシタビ 21500AM
株式会社
ン 300mg
Z00400
東京都中
央区日本
橋 室 町 21-1
適応外
手術不能又は再発 適応外
乳癌
結腸・直腸癌
胃癌
【実施期間】
臨床研究の開始日
2017 年 5 月 9 日
臨床研究の終了予定日 2031 年 11 月 9 日
登録期間:6.5 年、追跡期間:登録終了後 7 年、解析期間 1 年、総研究期間:14.5 年
【予定症例数】
予定登録患者数:150 人
【現在の登録状況】
97 人(2023 年 2 月 22 日現在)
2