よむ、つかう、まなぶ。
資料3 先進医療Bの試験実施計画の変更について(告示番号19/jRCTs031180008) (3 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_31340.html |
| 出典情報 | 先進医療会議 先進医療技術審査部会(第146回 3/9)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
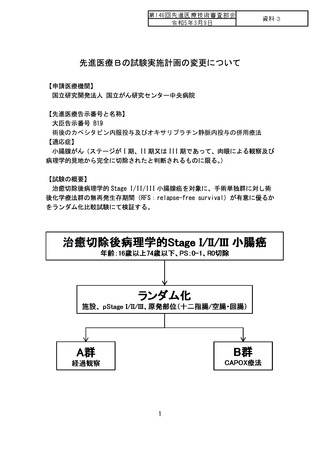
【主な変更内容】
① 登録期間の延長、予定登録患者数の変更
② 肝胆膵グループ研究事務局の交代、記載整備
【変更申請する理由】
① 登録期間の延長、予定登録患者数の変更
2022 年 11 月末日時点で、予定登録数 150 例の 59.3%である 89 例が登録さ
れています。これまでの患者登録ペースは約 1.3 例/月であり、本試験計画時
に見込んでいた 2 例/月よりも低調であるため、登録終了予定の 2023 年 11 月
までの登録完了が困難な状況であります。今回、予定登録期間を 6.5 年から
8 年に、予定登録数を 150 例から 115 例に変更いたします。
予定登録数について、プロトコール作成時に JCOG 大腸がんグループ/肝胆
膵グループで実施したアンケート調査の結果を基に標準治療群の 3 年無再発
生存期間(RFS)を 70%、試験治療群で術後 CAPOX 療法を行うことによる上乗
せを 10%として 3 年 RFS 80%を見込んでおりました。片側α=10%、検出力=70%、
登録期間 6 年、追跡期間 3 年で必要解析対象数を算出すると 144 例となり、
若干の追跡不能例等を見込んで予定登録数を 150 例と設定しておりました。
しかし、2022 年度前期モニタリングレポートでは、2022 年 4 月 8 日までの
全登録例 79 例の 3 年 RFS は 65.4%であり、標準治療の 3 年 RFS に想定(70%)
から乖離があることが判明しました。上記アンケート調査における Stage
IIIA/IIIB の割合が 42.2%(51/121)であったのに対し、2022 年度前期モニタ
リングレポートでは 53.7%(44/82)と、より病期が進行した患者の登録が多
いことが当初の想定と乖離がある理由と判断しています。この背景としては、
アンケート調査では十二指腸原発と小腸原発例の割合が 7:3 であったのに対
し、2022 年度前期モニタリングレポートでは 4:6 と、出血や腸閉塞などを契
機に発見されることが多い小腸原発例が想定より多く登録されていることが
影響していると考えています。そのため、2022 年度前期モニタリングレポー
トを基に標準治療の 3 年 RFS を 60%に下方修正してハザード比は現行の 0.63
から変更せず必要解析対象数を算出すると 112 例となり、若干の追跡不能例
等を見込んで予定登録数を 115 例に変更いたします。
今後も引き続き登録ペースを改善する策を講じて参りますが、現時点では
現在の登録ペースが大幅に上がる見込みは少なく、登録終了予定の 2023 年 11
月までに下方修正した予定登録数の 115 例に及びません。本疾患の希少性か
ら登録ペースのバラツキも考慮して、予定登録期間を 6.5 年から 8 年に延長
いたします。
調査した限りでは、小腸腺癌を対象とした周術期治療についての新規治療
開発や競合試験の情報はなく、超希少疾患を対象とした企業治験が行われる
可能性も極めて低いと考えますので、登録期間を延長しても本試験の意義は
保たれると考えております。
3
① 登録期間の延長、予定登録患者数の変更
② 肝胆膵グループ研究事務局の交代、記載整備
【変更申請する理由】
① 登録期間の延長、予定登録患者数の変更
2022 年 11 月末日時点で、予定登録数 150 例の 59.3%である 89 例が登録さ
れています。これまでの患者登録ペースは約 1.3 例/月であり、本試験計画時
に見込んでいた 2 例/月よりも低調であるため、登録終了予定の 2023 年 11 月
までの登録完了が困難な状況であります。今回、予定登録期間を 6.5 年から
8 年に、予定登録数を 150 例から 115 例に変更いたします。
予定登録数について、プロトコール作成時に JCOG 大腸がんグループ/肝胆
膵グループで実施したアンケート調査の結果を基に標準治療群の 3 年無再発
生存期間(RFS)を 70%、試験治療群で術後 CAPOX 療法を行うことによる上乗
せを 10%として 3 年 RFS 80%を見込んでおりました。片側α=10%、検出力=70%、
登録期間 6 年、追跡期間 3 年で必要解析対象数を算出すると 144 例となり、
若干の追跡不能例等を見込んで予定登録数を 150 例と設定しておりました。
しかし、2022 年度前期モニタリングレポートでは、2022 年 4 月 8 日までの
全登録例 79 例の 3 年 RFS は 65.4%であり、標準治療の 3 年 RFS に想定(70%)
から乖離があることが判明しました。上記アンケート調査における Stage
IIIA/IIIB の割合が 42.2%(51/121)であったのに対し、2022 年度前期モニタ
リングレポートでは 53.7%(44/82)と、より病期が進行した患者の登録が多
いことが当初の想定と乖離がある理由と判断しています。この背景としては、
アンケート調査では十二指腸原発と小腸原発例の割合が 7:3 であったのに対
し、2022 年度前期モニタリングレポートでは 4:6 と、出血や腸閉塞などを契
機に発見されることが多い小腸原発例が想定より多く登録されていることが
影響していると考えています。そのため、2022 年度前期モニタリングレポー
トを基に標準治療の 3 年 RFS を 60%に下方修正してハザード比は現行の 0.63
から変更せず必要解析対象数を算出すると 112 例となり、若干の追跡不能例
等を見込んで予定登録数を 115 例に変更いたします。
今後も引き続き登録ペースを改善する策を講じて参りますが、現時点では
現在の登録ペースが大幅に上がる見込みは少なく、登録終了予定の 2023 年 11
月までに下方修正した予定登録数の 115 例に及びません。本疾患の希少性か
ら登録ペースのバラツキも考慮して、予定登録期間を 6.5 年から 8 年に延長
いたします。
調査した限りでは、小腸腺癌を対象とした周術期治療についての新規治療
開発や競合試験の情報はなく、超希少疾患を対象とした企業治験が行われる
可能性も極めて低いと考えますので、登録期間を延長しても本試験の意義は
保たれると考えております。
3