よむ、つかう、まなぶ。
資料3 先進医療Bの試験実施計画の変更について(告示番号66/ jRCTs031220351) (3 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_33355.html |
| 出典情報 | 先進医療会議 先進医療技術審査部会(第149回 6/15)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
(死亡または後遺障害)に対しては
によって生じた健康被害の治療に要
「臨床研究保険」に従って補償を行
した治療費のうち、医療費以外の諸
います。詳しくは「別紙 2:臨床試験
手当)を「臨床研究保険」の支払限度
に伴う健康被害に対する補償の概要
額の範囲内でお支払いします。なお、
について」をご覧ください。
この臨床試験に関連して発生した一
定水準を超える健康被害(死亡また
は後遺障害)に対しては「臨床研究保
険」に従って補償を行います。詳しく
は「別紙 2:臨床試験に伴う健康被害
に対する補償の概要について」をご
覧ください。
下線文字:修正箇所
② 研究期間の変更
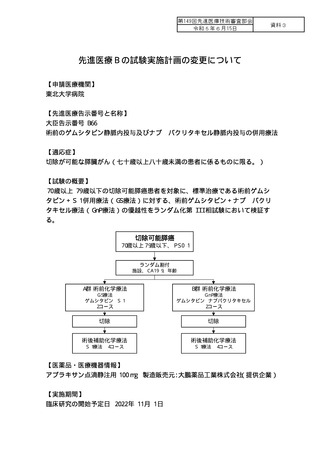
試験実施計画書の臨床研究の開始予定日を実際の開始日に修正いたします。
先進医療合同会議で本試験が承認された後に薬剤提供者である大鵬薬品工
業株式会社との契約締結に加え、補償保険、薬剤管理の手続き等を行ったた
め、実際の登録開始日は 2023 年 1 月 5 日となりました。そのため、研究終
了予定日を実際の登録開始日に合わせ修正するため追記事項を記しました。
旧文書
新文書
0.5.予定登録数と研究期間
0.5.予定登録数と研究期間
予定登録数:400 人
予定登録数:400 人
予定登録期間:3 年。追跡期間:登録終了 予定登録期間:3 年。追跡期間:登録終
後 3 年。解析期間:1 年。総研究期間:7 年 了後 3 年。解析期間:1 年。総研究期間:
臨床研究の開始予定日 2022 年 11 月 1 日 7 年
臨床研究の終了予定日 2029 年 10 月 31 日 <ver. 1.2.0 での追記事項>
研究開始日は jRCT 公表日の 2022 年 10
月 1 日であるが、実際の登録開始日は
2023 年 1 月 5 日であるため、研究終了
によって生じた健康被害の治療に要
「臨床研究保険」に従って補償を行
した治療費のうち、医療費以外の諸
います。詳しくは「別紙 2:臨床試験
手当)を「臨床研究保険」の支払限度
に伴う健康被害に対する補償の概要
額の範囲内でお支払いします。なお、
について」をご覧ください。
この臨床試験に関連して発生した一
定水準を超える健康被害(死亡また
は後遺障害)に対しては「臨床研究保
険」に従って補償を行います。詳しく
は「別紙 2:臨床試験に伴う健康被害
に対する補償の概要について」をご
覧ください。
下線文字:修正箇所
② 研究期間の変更
試験実施計画書の臨床研究の開始予定日を実際の開始日に修正いたします。
先進医療合同会議で本試験が承認された後に薬剤提供者である大鵬薬品工
業株式会社との契約締結に加え、補償保険、薬剤管理の手続き等を行ったた
め、実際の登録開始日は 2023 年 1 月 5 日となりました。そのため、研究終
了予定日を実際の登録開始日に合わせ修正するため追記事項を記しました。
旧文書
新文書
0.5.予定登録数と研究期間
0.5.予定登録数と研究期間
予定登録数:400 人
予定登録数:400 人
予定登録期間:3 年。追跡期間:登録終了 予定登録期間:3 年。追跡期間:登録終
後 3 年。解析期間:1 年。総研究期間:7 年 了後 3 年。解析期間:1 年。総研究期間:
臨床研究の開始予定日 2022 年 11 月 1 日 7 年
臨床研究の終了予定日 2029 年 10 月 31 日 <ver. 1.2.0 での追記事項>
研究開始日は jRCT 公表日の 2022 年 10
月 1 日であるが、実際の登録開始日は
2023 年 1 月 5 日であるため、研究終了