よむ、つかう、まなぶ。
資料2 先進医療Bの試験実施計画の変更について(告示番号44/ jRCTs051200076) (1 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_34841.html |
| 出典情報 | 先進医療会議 先進医療技術審査部会(第153回 9/14)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
先進医療Bの試験実施計画の変更について
【申請医療機関】
国立循環器病研究センター
【先進医療告示番号と名称】
大臣告示番号 B44
遺伝子組換え活性型血液凝固第Ⅶ因子製剤静脈内投与療法
【適応症】
脳出血(発症から二時間以内 のものに限る。)
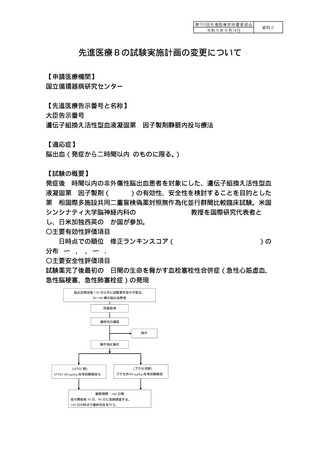
【試験の概要】
発症後 2 時間以内の非外傷性脳出血患者を対象にした、遺伝子組換え活性型血
液凝固第Ⅶ因子製剤(rFVIIa)の有効性、安全性を検討することを目的とした
第Ⅲ相国際多施設共同二重盲検偽薬対照無作為化並行群間比較臨床試験。米国
シンシナティ大学脳神経内科の Joseph Broderick 教授を国際研究代表者と
し、日米加独西英の 6 か国が参加。
〇主要有効性評価項目
180 日時点での順位 修正ランキンスコア(modified Rankin Scale: mRS)の
分布 0〜2,3,4〜6.
〇主要安全性評価項目
試験薬完了後最初の 4 日間の生命を脅かす血栓塞栓性合併症(急性心筋虚血、
急性脳梗塞、急性肺塞栓症)の発現
脳出血発症後 120 分以内に試験薬を投与可能な、
20〜80 歳の脳出血患者
同意取得
適格性の確認
除外
無作為化割付
[プラセボ群]
[rFVII 群]
rFVII (80 µg/kg)を単回静脈投与
プラセボ(80 µg/kg)を単回静脈投
観察期間:180 日間
投与開始後 30 日、90 日に追跡調査する。
180 日の時点で最終判定を行う。
【申請医療機関】
国立循環器病研究センター
【先進医療告示番号と名称】
大臣告示番号 B44
遺伝子組換え活性型血液凝固第Ⅶ因子製剤静脈内投与療法
【適応症】
脳出血(発症から二時間以内 のものに限る。)
【試験の概要】
発症後 2 時間以内の非外傷性脳出血患者を対象にした、遺伝子組換え活性型血
液凝固第Ⅶ因子製剤(rFVIIa)の有効性、安全性を検討することを目的とした
第Ⅲ相国際多施設共同二重盲検偽薬対照無作為化並行群間比較臨床試験。米国
シンシナティ大学脳神経内科の Joseph Broderick 教授を国際研究代表者と
し、日米加独西英の 6 か国が参加。
〇主要有効性評価項目
180 日時点での順位 修正ランキンスコア(modified Rankin Scale: mRS)の
分布 0〜2,3,4〜6.
〇主要安全性評価項目
試験薬完了後最初の 4 日間の生命を脅かす血栓塞栓性合併症(急性心筋虚血、
急性脳梗塞、急性肺塞栓症)の発現
脳出血発症後 120 分以内に試験薬を投与可能な、
20〜80 歳の脳出血患者
同意取得
適格性の確認
除外
無作為化割付
[プラセボ群]
[rFVII 群]
rFVII (80 µg/kg)を単回静脈投与
プラセボ(80 µg/kg)を単回静脈投
観察期間:180 日間
投与開始後 30 日、90 日に追跡調査する。
180 日の時点で最終判定を行う。