よむ、つかう、まなぶ。
資料2 先進医療Bの試験実施計画の変更について(告示番号44/ jRCTs051200076) (2 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_34841.html |
| 出典情報 | 先進医療会議 先進医療技術審査部会(第153回 9/14)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
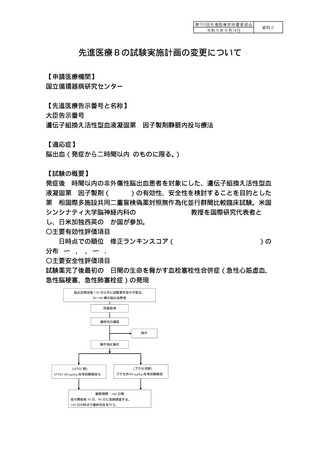
【医薬品・医療機器情報】
ノボセブ ノ ボ ノ ル 1mg
医薬品医
療機器法
上の適応
外使用の
該当
(注2)
22600AMX00908000 血液凝固第Ⅷ因子又 適応外
ン®
デ ィ ス ク 2mg
22600AMX00909000 は第Ⅸ因子に対する
フ ァ ー マ 5mg
22600AMX00910000 インヒビターを保有
Novo
22600AMX01282000 する先天性血友病患
品目名
製造販売
業者名及
び連絡先
規
格
8mg
医薬品医療機器法
承認
又は
認証番号
(16桁)
医薬品医療機器法承
認又は
認証上の適応
(注1)
Nordisk
者の出血抑制・後天
A/S,
性血友病患者の出血
Novo
抑制・先天性第Ⅶ因
Allé,
子欠乏症患者におけ
2880
る出血傾向の抑制・
Bagsværd,
血小板に対する同種
Denmark
抗体を保有し,血小
+45
板輸血不応状態が過
4444
8888
去又は現在みられる
グランツマン血小板
無力症患者の出血傾
向の抑制
【実施期間】
被験者登録期間:jRCT 公表日(2020 年 11 月1日)〜2024 年3月 31 日
研究実施期間:jRCT 公表日(2020 年 11 月1日)〜2026 年3月 31 日
【予定症例数】
860 名(rFVII 群 430 例、プラセボ群 430 例)
(国内からは 300 例を登録予定)
【現在の登録状況】
日本国内 107 症例(2023 年7月 31 日現在)
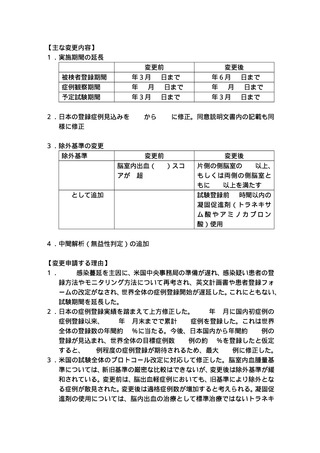
ノボセブ ノ ボ ノ ル 1mg
医薬品医
療機器法
上の適応
外使用の
該当
(注2)
22600AMX00908000 血液凝固第Ⅷ因子又 適応外
ン®
デ ィ ス ク 2mg
22600AMX00909000 は第Ⅸ因子に対する
フ ァ ー マ 5mg
22600AMX00910000 インヒビターを保有
Novo
22600AMX01282000 する先天性血友病患
品目名
製造販売
業者名及
び連絡先
規
格
8mg
医薬品医療機器法
承認
又は
認証番号
(16桁)
医薬品医療機器法承
認又は
認証上の適応
(注1)
Nordisk
者の出血抑制・後天
A/S,
性血友病患者の出血
Novo
抑制・先天性第Ⅶ因
Allé,
子欠乏症患者におけ
2880
る出血傾向の抑制・
Bagsværd,
血小板に対する同種
Denmark
抗体を保有し,血小
+45
板輸血不応状態が過
4444
8888
去又は現在みられる
グランツマン血小板
無力症患者の出血傾
向の抑制
【実施期間】
被験者登録期間:jRCT 公表日(2020 年 11 月1日)〜2024 年3月 31 日
研究実施期間:jRCT 公表日(2020 年 11 月1日)〜2026 年3月 31 日
【予定症例数】
860 名(rFVII 群 430 例、プラセボ群 430 例)
(国内からは 300 例を登録予定)
【現在の登録状況】
日本国内 107 症例(2023 年7月 31 日現在)