よむ、つかう、まなぶ。
【資料2】柏谷構成員提出資料 (2 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_36390.html |
| 出典情報 | 創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会(第6回 12/13)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
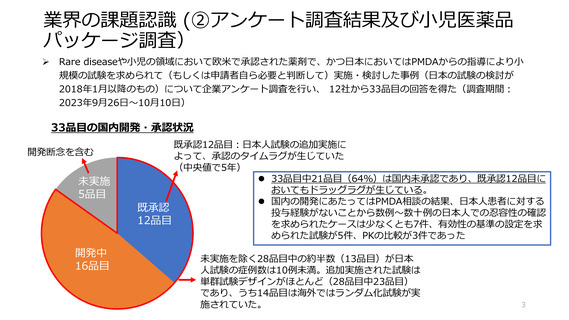
業界の課題認識 (①一般的な課題)
➢ これまで、希少疾患等に用いる医薬品について外国で検証的な臨床試験結果が得られている場合などには、承
認申請にあたりPMDAとの対面助言を活用するなどした上で、日本人患者の投与経験の蓄積の観点から少数例
の忍容性を確認する試験や少数の日本人患者で安全性・有効性を評価する試験を可能な限り実施してきた。
【少数例の日本人患者での臨床試験の実施に際し、一般的に問題点と考えられる事項】
◼ 少数例の日本人患者の試験では、安全性や有効性を評価することは難しく、また推定精度も低いことか
ら、外国の臨床試験成績と比較して明確な結論を導くことは困難である。
◼ 対面助言では、フィージビリティも考慮された上で、日本人患者における安全性評価のため数例〜数⼗
例を要求されるのが現状である。また、閾値となる有効性を設定した数⼗例の単群試験等で評価する場
合、少数例のため、患者背景の偏りによって結果は大きく影響を受ける。
◼ 一方、試験の立ち上げにあたっては、ごく小規模の試験であっても相応の費用・時間を要する。また希
少疾患であれば症例組み入れに時間を要することが多く、継続的に費用が発生する。
◼ 治験実施に相応の時間を要し、ドラッグラグの大きな要因の一つとなっている。また、フィージビリ
ティ等の観点から治験の実施は困難であり、企業判断により国内開発を断念せざるを得ないケースもあ
る。
➢ 検証的試験(国際共同試験)に日本も参画する場合、希少疾患等に用いる医薬品については多数の日本人患者
を組み入れることは難しく、日本人例数が少数例である場合には全体集団と日本人集団の成績を比較して日本
人の有効性・安全性に関する結論を導くことは困難である。
2
➢ これまで、希少疾患等に用いる医薬品について外国で検証的な臨床試験結果が得られている場合などには、承
認申請にあたりPMDAとの対面助言を活用するなどした上で、日本人患者の投与経験の蓄積の観点から少数例
の忍容性を確認する試験や少数の日本人患者で安全性・有効性を評価する試験を可能な限り実施してきた。
【少数例の日本人患者での臨床試験の実施に際し、一般的に問題点と考えられる事項】
◼ 少数例の日本人患者の試験では、安全性や有効性を評価することは難しく、また推定精度も低いことか
ら、外国の臨床試験成績と比較して明確な結論を導くことは困難である。
◼ 対面助言では、フィージビリティも考慮された上で、日本人患者における安全性評価のため数例〜数⼗
例を要求されるのが現状である。また、閾値となる有効性を設定した数⼗例の単群試験等で評価する場
合、少数例のため、患者背景の偏りによって結果は大きく影響を受ける。
◼ 一方、試験の立ち上げにあたっては、ごく小規模の試験であっても相応の費用・時間を要する。また希
少疾患であれば症例組み入れに時間を要することが多く、継続的に費用が発生する。
◼ 治験実施に相応の時間を要し、ドラッグラグの大きな要因の一つとなっている。また、フィージビリ
ティ等の観点から治験の実施は困難であり、企業判断により国内開発を断念せざるを得ないケースもあ
る。
➢ 検証的試験(国際共同試験)に日本も参画する場合、希少疾患等に用いる医薬品については多数の日本人患者
を組み入れることは難しく、日本人例数が少数例である場合には全体集団と日本人集団の成績を比較して日本
人の有効性・安全性に関する結論を導くことは困難である。
2