よむ、つかう、まなぶ。
【資料2】柏谷構成員提出資料 (3 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_36390.html |
| 出典情報 | 創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会(第6回 12/13)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
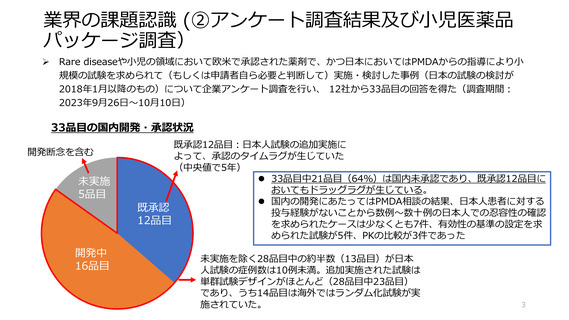
業界の課題認識 (②アンケート調査結果及び小児医薬品
パッケージ調査)
➢ Rare diseaseや小児の領域において欧米で承認された薬剤で、かつ日本においてはPMDAからの指導により小
規模の試験を求められて(もしくは申請者自ら必要と判断して)実施・検討した事例(日本の試験の検討が
2018年1月以降のもの)について企業アンケート調査を行い、 12社から33品目の回答を得た(調査期間:
2023年9月26日〜10月10日)
33品目の国内開発・承認状況
開発断念を含む
未実施
5品目
開発中
16品目
既承認12品目:日本人試験の追加実施に
よって、承認のタイムラグが生じていた
(中央値で5年)
⚫ 33品目中21品目(64%)は国内未承認であり、既承認12品目に
おいてもドラッグラグが生じている。
⚫ 国内の開発にあたってはPMDA相談の結果、日本人患者に対する
既承認
投与経験がないことから数例〜数⼗例の日本人での忍容性の確認
12品目
を求められたケースは少なくとも7件、有効性の基準の設定を求
められた試験が5件、PKの比較が3件であった
未実施を除く28品目中の約半数(13品目)が日本
人試験の症例数は10例未満。追加実施された試験は
単群試験デザインがほとんど(28品目中23品目)
であり、うち14品目は海外ではランダム化試験が実
施されていた。
3
パッケージ調査)
➢ Rare diseaseや小児の領域において欧米で承認された薬剤で、かつ日本においてはPMDAからの指導により小
規模の試験を求められて(もしくは申請者自ら必要と判断して)実施・検討した事例(日本の試験の検討が
2018年1月以降のもの)について企業アンケート調査を行い、 12社から33品目の回答を得た(調査期間:
2023年9月26日〜10月10日)
33品目の国内開発・承認状況
開発断念を含む
未実施
5品目
開発中
16品目
既承認12品目:日本人試験の追加実施に
よって、承認のタイムラグが生じていた
(中央値で5年)
⚫ 33品目中21品目(64%)は国内未承認であり、既承認12品目に
おいてもドラッグラグが生じている。
⚫ 国内の開発にあたってはPMDA相談の結果、日本人患者に対する
既承認
投与経験がないことから数例〜数⼗例の日本人での忍容性の確認
12品目
を求められたケースは少なくとも7件、有効性の基準の設定を求
められた試験が5件、PKの比較が3件であった
未実施を除く28品目中の約半数(13品目)が日本
人試験の症例数は10例未満。追加実施された試験は
単群試験デザインがほとんど(28品目中23品目)
であり、うち14品目は海外ではランダム化試験が実
施されていた。
3