よむ、つかう、まなぶ。
【資料2】柏谷構成員提出資料 (4 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_36390.html |
| 出典情報 | 創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会(第6回 12/13)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
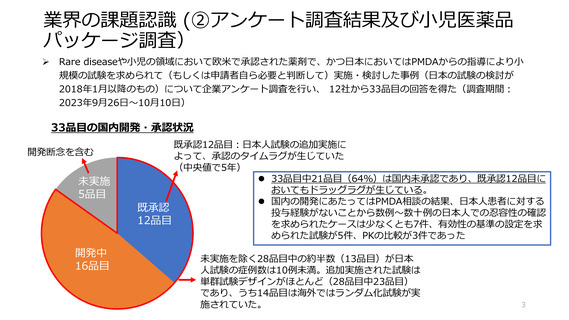
業界の課題認識 (②アンケート調査結果及び小児医薬品
パッケージ調査)
➢ 2018年4月から2023年3月までの間に日本で承認された小児医薬品89品目のパッケージ調査を行った。
◼ 「日本人の小児患者を対象とした試験が評価資料として提出された」品目数は55品目であり、55品目中
24品目の日本人小児患者試験は例数が20例以下の小規模なものであった。
◼ 55品目中「日本人の小児患者を対象とした試験の登録例数が20人未満」であり、かつ「日本で試験を追
加実施されたと考えられる」(=小規模追加試験と考えられるもの)品目数は12品目であり、うち11品
目では単群試験が実施された。また承認ラグ(欧米での初の承認〜日本の承認)は1年以内〜数⼗年で
あった。日本で追加実施されたと考えられた試験は単群試験がほとんどであって、仮説を検証できる試
験ではなかった。
(二つの調査のまとめ)
希少疾患や小児医薬品等について日本で実施された追加試験は小規模な試験がほとんどで
あった。症例数が限られるため、統計的意味のある試験を日本単独で実施することや、ご
く少数例の試験で民族差の有無を議論することは困難である。
また、希少疾患等を対象とするため、少数例での治験であっても症例収集には時間を要し、
ドラッグラグの要因となっている。
4
パッケージ調査)
➢ 2018年4月から2023年3月までの間に日本で承認された小児医薬品89品目のパッケージ調査を行った。
◼ 「日本人の小児患者を対象とした試験が評価資料として提出された」品目数は55品目であり、55品目中
24品目の日本人小児患者試験は例数が20例以下の小規模なものであった。
◼ 55品目中「日本人の小児患者を対象とした試験の登録例数が20人未満」であり、かつ「日本で試験を追
加実施されたと考えられる」(=小規模追加試験と考えられるもの)品目数は12品目であり、うち11品
目では単群試験が実施された。また承認ラグ(欧米での初の承認〜日本の承認)は1年以内〜数⼗年で
あった。日本で追加実施されたと考えられた試験は単群試験がほとんどであって、仮説を検証できる試
験ではなかった。
(二つの調査のまとめ)
希少疾患や小児医薬品等について日本で実施された追加試験は小規模な試験がほとんどで
あった。症例数が限られるため、統計的意味のある試験を日本単独で実施することや、ご
く少数例の試験で民族差の有無を議論することは困難である。
また、希少疾患等を対象とするため、少数例での治験であっても症例収集には時間を要し、
ドラッグラグの要因となっている。
4