よむ、つかう、まなぶ。
○最適使用推進ガイドラインについて(報告) 総ー6参考1 (5 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000212500_00231.html |
| 出典情報 | 中央社会保険医療協議会 総会(第572回 12/13)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
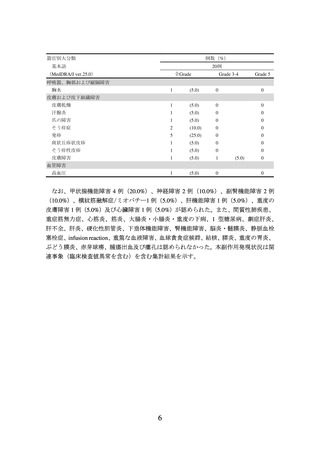
3.臨床成績
悪性中皮腫(悪性胸膜中皮腫を除く)の承認時に評価を行った主な臨床試験の成績を
示す。
【有効性】
① 国内第Ⅱ相試験(HCM-002 試験)
悪性胸膜中皮腫患者を除く悪性中皮腫患者 20 例を対象に、本剤 240 mg を 2 週間間隔
で点滴静注した。主要評価項目とされた中央判定による測定可能病変を有する患者(14
(注1)
例)
における奏効率(RECIST ガイドライン 1.1 版に基づく CR 又は PR)は 35.7%
(95%信頼区間:12.8~64.9%)であった。また、試験において禁止された治療が実施さ
れた後に得られた有効性データを解析から除外した場合の全体集団における中央判定
による奏効率は、20.0%(95%信頼区間:5.7~43.7%)であった。
悪性腹膜中皮腫患者及び悪性心膜中皮腫患者がそれぞれ 19 例及び 1 例組み入れられ、主要評価項
目の解析対象とされた患者は、それぞれ 13 例及び 1 例であった。データカットオフ日後に改訂された
統計解析計画書に基づき、試験において禁止された治療後に得られた有効性データが採用され、部分
奏効(PR)と判定された患者 1 例が含まれる。
(注1)
4
悪性中皮腫(悪性胸膜中皮腫を除く)の承認時に評価を行った主な臨床試験の成績を
示す。
【有効性】
① 国内第Ⅱ相試験(HCM-002 試験)
悪性胸膜中皮腫患者を除く悪性中皮腫患者 20 例を対象に、本剤 240 mg を 2 週間間隔
で点滴静注した。主要評価項目とされた中央判定による測定可能病変を有する患者(14
(注1)
例)
における奏効率(RECIST ガイドライン 1.1 版に基づく CR 又は PR)は 35.7%
(95%信頼区間:12.8~64.9%)であった。また、試験において禁止された治療が実施さ
れた後に得られた有効性データを解析から除外した場合の全体集団における中央判定
による奏効率は、20.0%(95%信頼区間:5.7~43.7%)であった。
悪性腹膜中皮腫患者及び悪性心膜中皮腫患者がそれぞれ 19 例及び 1 例組み入れられ、主要評価項
目の解析対象とされた患者は、それぞれ 13 例及び 1 例であった。データカットオフ日後に改訂された
統計解析計画書に基づき、試験において禁止された治療後に得られた有効性データが採用され、部分
奏効(PR)と判定された患者 1 例が含まれる。
(注1)
4