よむ、つかう、まなぶ。
資料1-4 市販後安全性情報に関する報告(製造販売業者の公表資料)[1.7MB] (12 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_37454.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会安全対策調査会(令和5年度第14回 1/23)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
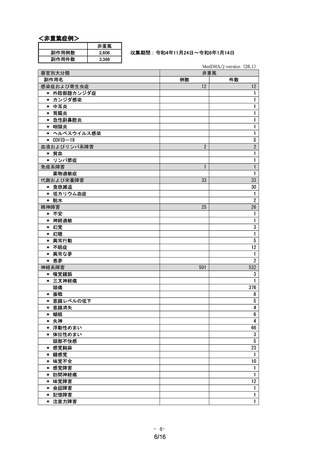
<重要な潜在的リスク>【医薬品リスク管理計画書からの抜粋、一部改編】2023 年 8 月作成版
催奇形性
重要な潜在的リスクとした理由:
生殖発生毒性試験において、ウサギでは、臨床曝露量の 5.0 倍相当以上で胎児に催奇形性が認められてい
る。ラットでは、同様の異常は認められていない。
臨床試験において、妊娠中の女性への本剤の投与経験はない。
以上より、催奇形性を重要な潜在的リスクと設定した。
医薬品安全性監視活動の内容:
・ 通常の医薬品安全性監視活動
リスク最小化活動の内容:
【内容】
・ 通常のリスク最小化活動として、添付文書の「2. 禁忌」
、
「9.4 生殖能を有する者」
、
「9.5 妊婦」の項
及び「患者向医薬品ガイド」に記載して注意喚起を行う。
・ 追加のリスク最小化活動として、
「医療従事者向け資材」
:
『「妊娠している女性、妊娠している可能性
のある女性、又は妊娠する可能性のある女性」に関するお願い』及び「患者向け資材」:
「ゾコーバ®
錠 125mg を処方された女性の患者さんとご家族のみなさまへ」の作成及び提供を行う。
【添付文書からの抜粋】2023 年 12 月改訂[第 9 版:国購入品(凸錠)
、10 版:一般流通品(薬価収載品)共通]
2.禁忌(次の患者には投与しないこと)
(略)
2.4 妊婦又は妊娠している可能性のある女性[9.5 参照]
2023 年 12 月 22 日付「市販後安全性情報に関するご報告【第 7 回】」において本剤投与後に妊
娠が確認された症例が 34 例(疑い 6 例含む)集積されていることをご報告いたしました。
今回の集計において新たな集積はありませんが、疑い 6 例のうち 3 例で追加情報を収集し、妊
娠していることが確認されましたので、最新情報は、合計 34 例(疑い 3 例含む)となりました。
また、転帰として、新たに「流産」された症例 1 例が確認され、既にご報告した症例を含めて
「流産」された症例は 3 例となりました。
今回の症例の報告医は、自然流産※と考えられることから、本剤の影響については「関連なし」
と判断されています。弊社としましては、既報告の 2 例と同様に評価するための情報が不足して
いることから、本剤の影響については「不明」と判断しています。このように、現時点では、
「流
産」の原因は明確ではありませんので、本剤或いは自然流産※の可能性も含めて、引き続き、症例
の集積に留意いたします。
なお、今回の集計でも妊娠に関わる他の副作用は報告されておりません。
※:医療機関で確認された妊娠の 15%前後が流産になります。妊娠 12 週未満の早い時期での流産が 8 割以上で
ありほとんどを占めます。人工流産以外の自然に起きる流産のことすべてを自然流産と言います。
【出典】 公益社団法人 日本産科婦人科学会ホームページ
引き続き、
「妊娠する可能性のある女性」に本剤をお渡しされる際の手順についてご確認をお願
い申し上げます。
- 1012/16
催奇形性
重要な潜在的リスクとした理由:
生殖発生毒性試験において、ウサギでは、臨床曝露量の 5.0 倍相当以上で胎児に催奇形性が認められてい
る。ラットでは、同様の異常は認められていない。
臨床試験において、妊娠中の女性への本剤の投与経験はない。
以上より、催奇形性を重要な潜在的リスクと設定した。
医薬品安全性監視活動の内容:
・ 通常の医薬品安全性監視活動
リスク最小化活動の内容:
【内容】
・ 通常のリスク最小化活動として、添付文書の「2. 禁忌」
、
「9.4 生殖能を有する者」
、
「9.5 妊婦」の項
及び「患者向医薬品ガイド」に記載して注意喚起を行う。
・ 追加のリスク最小化活動として、
「医療従事者向け資材」
:
『「妊娠している女性、妊娠している可能性
のある女性、又は妊娠する可能性のある女性」に関するお願い』及び「患者向け資材」:
「ゾコーバ®
錠 125mg を処方された女性の患者さんとご家族のみなさまへ」の作成及び提供を行う。
【添付文書からの抜粋】2023 年 12 月改訂[第 9 版:国購入品(凸錠)
、10 版:一般流通品(薬価収載品)共通]
2.禁忌(次の患者には投与しないこと)
(略)
2.4 妊婦又は妊娠している可能性のある女性[9.5 参照]
2023 年 12 月 22 日付「市販後安全性情報に関するご報告【第 7 回】」において本剤投与後に妊
娠が確認された症例が 34 例(疑い 6 例含む)集積されていることをご報告いたしました。
今回の集計において新たな集積はありませんが、疑い 6 例のうち 3 例で追加情報を収集し、妊
娠していることが確認されましたので、最新情報は、合計 34 例(疑い 3 例含む)となりました。
また、転帰として、新たに「流産」された症例 1 例が確認され、既にご報告した症例を含めて
「流産」された症例は 3 例となりました。
今回の症例の報告医は、自然流産※と考えられることから、本剤の影響については「関連なし」
と判断されています。弊社としましては、既報告の 2 例と同様に評価するための情報が不足して
いることから、本剤の影響については「不明」と判断しています。このように、現時点では、
「流
産」の原因は明確ではありませんので、本剤或いは自然流産※の可能性も含めて、引き続き、症例
の集積に留意いたします。
なお、今回の集計でも妊娠に関わる他の副作用は報告されておりません。
※:医療機関で確認された妊娠の 15%前後が流産になります。妊娠 12 週未満の早い時期での流産が 8 割以上で
ありほとんどを占めます。人工流産以外の自然に起きる流産のことすべてを自然流産と言います。
【出典】 公益社団法人 日本産科婦人科学会ホームページ
引き続き、
「妊娠する可能性のある女性」に本剤をお渡しされる際の手順についてご確認をお願
い申し上げます。
- 1012/16