よむ、つかう、まなぶ。
資料2-2 医療機器基本計画に関する各省における取り組みの状況について (4 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_38515.html |
| 出典情報 | 国民が受ける医療の質の向上のための医療機器の研究開発及び普及の促進に関する検討会(第4回 3/12)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
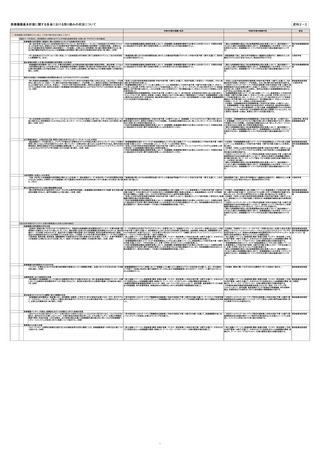
該当箇所 列1 列2
列3
令和5年度の実績・状況
令和6年度の取組予定
担当
(2)「革新的な医療機器が世界に先駆けて我が国に上市される魅力的な環境の構築」に向けて
【早期実用化に向けた薬事承認制度・審査体制の構築】
Software as a Medical Device(SaMD)の実用化促進
・「SaMD米国調査及び国内制度整備事業」(令和5年度)を実施した。
・「プログラム医療機器に係る優先的な審査等の試行的実施について」を継続する。
厚労省医療機器審査
の進捗を引き続きフォローアップするとともに、医療機器の研究開発の進展を踏まえ、迅速な実用化に向け、必要に応じて ・「プログラム医療機器の特性を踏まえた適切かつ迅速な承認及び開発のためのガイダンスの公表について」(令和5年5月29日 ・新たなプログラム医療機器の審査ポイント及び認証基準を策定する。
管理課
新たな支援策に取り組む。[◎厚]
事務連絡)を公表した。
・令和5年9月6日に「プログラム医療機器実用化促進パッケージ戦略2(DASH for
・「プログラム医療機器に係る優先的な審査等の試行的実施(第二回)について」(令和5年6月30日付け薬生機審発 0630 第2 SaMD2)」を踏まえ、引き続き、薬事承認・保険適用までの予見可能性の確保や、日本
号)を公表し、令和6年1月16日に優先的な審査等の対象品目として3品目の指定を行った。
発プログラム医療機器の研究開発の加速・国際市場への展開の推進に向けた取組み
・令和5年9月6日に「プログラム医療機器実用化促進パッケージ戦略2(DASH for SaMD:DX (Digital Transformation) Action
を継続する。
Strategies in Healthcare for SaMD (Software as a Medical Device) 2)」を公表した。
・「プログラム医療機器の特性を踏まえた二段階承認に係る取扱いについて」(令和5年11月16日付け医薬機審発1116第2号)を
公表した。
「プログラム医療機器の変更計画の確認申請に関する申請書及び添付資料の記載事例について」(令和5年12月22日付け事務
連絡)を公表した。
・「医療機器、人工知能関連技術を活用した医療機器、プログラム医療機器の変更計画の確認申請に関する質疑応答集(Q&
A)について」(令和5年12月22日付け事務連絡)を公表した。
・「プログラム医療機器の特性を踏まえた二段階承認に係る取扱いについて」(令和5年11月16日付け医薬機審発1116第2号)
に関するQ&Aを令和5年度中に公表予定。
・令和5年9月21日にSaMD産学官連携フォーラムを開催した。
・令和6年2月7日にSaMD産学官サブフォーラムを開催した。
・SaMD産学官連携フォーラム、SaMD産学官サブフォーラムを開催する。
サイバーセキュリティに関する規格・手引きの整備
今後、SaMD等の外部のネットワークと接続し、機能を発揮する医療機器においてはユーザーを含む各ステークホルダー ・令和5年度末の医療機器のサイバーセキュリティの確保を目的とした医療機器の基本要件基準の改正(第12条第3項の追加)
によるサイバーセキュリティの担保が重要であり、各ステークホルダーにおける責任分担等、現場への実装に向けて検討 に関連して、製造販売業者が対応すべき内容について、「医療機器の基本要件基準第 12 条第3項の適合性の確認について」
が必要な論点を整理しつつ、各製品において必要なサイバーセキュリティに関する規格や手引きの整備に取り組む。[◎ (令和5年5月23日付け薬生機審発0523第1号)や「医療機器の基本要件基準第 12 条第3項の適用に関する質疑応答集(Q&
厚]
A)について」(令和5年7月20日事務連絡)等で明確化した。
厚労省医療機器審査
管理課(経済産業省
医福室)
・製造販売業者等が実施すべき医療機器のサイバーセキュリティ対策について、
厚労省医療機器審査
SBOMの利活用やレガシー医療機器に向けた対策といった、国際的にも議論されてい 管理課・医薬安全対
る内容について、本邦においても製造販売業者への調査を行い、製造販売業者向け 策課
の手引書の改訂等を実施する。
有事における新規医療機器の早期実用化に向けた取組
有事において、臨床現場に必要とされる医療機器が早期に研究開発され、上市されるために必要な環境の整備に取り ・令和4年5月薬機法改正により、感染症拡大などの有事における医療機器の緊急承認制度を導入した。(対応済み)
組む。[◎厚]
【医療保険制度におけるイノベーションに対する適切な評価の実施】
イノベーションへの適切な評価
我が国におけるSaMDを含めた革新的な医療機器の実用化を進めるため、保険医療材料制度等におけるイノベーション 令和6年度診療報酬改定において、
の適切な評価を、画期性・有用性に対する評価、新規医療材料を用いた技術の評価、機能区分の細分化、合理化及び定 ・チャレンジ権の取得に係る申請が可能な期間を拡大するとともに、対象に体外診断用医薬品を追加
義の見直し等により引き続き推進する。[◎厚]
・経済性に優れた医療機器に対する評価の新設
・希少疾病等の検査に用いる体外診断用医薬品等に対する評価の新設
・プログラム医療機器の特性を踏まえた制度の見直し
を行うとともに、臨床上の有用性等を踏まえた特定保険医療材料の機能区分の細分化・合理化等を実施した。
(対応済み)
厚労省医療機器審査
管理課
・令和6年診療報酬改定による影響を注視しつつ、保険適用希望のある医療機器につ 厚労省医療課
いて、適切な評価を行い迅速に保険適用する。
保険導入の手引きの作成
・令和6年度診療報酬改定を踏まえた「医療機器・体外診断用医薬品の保険適用に関 厚労省医療機器政策
するガイドブック」を作成する予定である。
室
-
【規制調和の促進や日本を参照国制度の対象とする国の充実等による日本の薬事承認の国際的な意義の向上】
国際的な規制調和活動への積極的な参加
優れた医療機器の迅速な国内への導入を図れるようにするため、また国内に上市された製品を国際展開しようとした際 ・医療機器に関する国際的な規制調和活動について、次のとおり主体的な対応を行った。
・引き続き、医療機器の国際的な規制調和の場への主体的な参加を通じて、国際的な 厚労省医療機器審査
に他国の規制が障壁とならないようにするため、IMDRFやHBD等国際的な規制調和活動に引き続き取り組む。[◎厚]
・IMDRFについては、管理委員会・各WGに出席し、日本の規制基準が国際的に活用されるよう活動を行った。
ガイダンスの作成を進める。
管理課・国際薬事規
・HBDについては、日米産官学の関係者と毎月オンライン会議等の実施とともに、対面でのThink Tank Meetingを東京で令和5年 ・特に、日本は2025年にIMDRF議長国となっているところ、議長として管理委員会等を 制室
12月14日に開催した。
主催し、規制調和に係る議論を主導していく。
・令和4年度に加盟したGHWPについては、正式メンバーとして年次会合・技術委員会に参加するとともに、他参加国と医療機器
規制に関する意見交換を行った。
新興国・途上国に対する規制調和の促進及び日本を参照国制度の対象とする国の充実
中長期の市場拡大を考慮し、東南アジア地域等の新興国・途上国への日本企業の医療機器の国際展開を促進する取 ・令和5年度は、アジア医薬品・医療機器トレーニングセンターにおいて各国規制当局担当者向けに医療機器に関するセミナー ・引き続き、アジア医薬品・医療機器トレーニングセンターにおいて各国規制当局担当 厚労省医療機器審査
組も重要であり、アジア医薬品・医療機器トレーニングセンターの活動等を通じた規制調和や日本を参照国制度の対象と を3回開催した(対面1回、オンライン2回)。
者向けに医療機器に関するセミナーを開催するとともに、アジア諸国と日本を参照国と 管理課、国際薬事規
する国の充実に向けて引き続き取り組む。[◎厚]
・また、令和5年度は、タイ、台湾、インドネシア、韓国の医療機器当局とのバイ会合を開催し、日本を参照国とする対応に向けた する対応に向けた調整を進める。
制室
議論を進めた。
医療機器開発ガイドラインと国際標準化の活動強化
医療機器開発ガイドラインを有効に活用し、日本の薬事承認審査や製品特性を踏まえた内容がISO等の国際規格により ・「医療機器国際標準化戦略推進事業」により、医療機器等のISO/IEC等の国際規格について、日本の考え方が反映された規 ・「医療機器国際標準化戦略推進事業」により、引き続き、医療機器等のISO/IEC等 経済産業省医福室、
適切に反映されるように、国際規格の策定プロセスにおいて主導的な役割を果たすための体制の整備に引き続き取り組 格の国際標準化の促進を行った。また、国際標準化推進に関し、ASEAN加盟国を対象とした医療機器の基準等に関するワーク の国際規格について、日本の考え方が反映された規格の国際標準化等の促進を行っ 厚労省医療機器審査
む。[◎厚、◎経]
ショップを令和5年12月4日に開催した。
ていく。
管理課
・「医療機器等における開発ガイドライン策定事業」(先進的研究開発・開発体制強靱化事業 令和5年度予算:40億円の内数)を ・引き続き、「医療機器等における開発ガイドライン策定事業」(先進的研究開発・開発
通じて、医療機器等の開発における工学的安定性や生物学的安定性に関する各評価項目の試験方法等を、医療機器開発ガイ 体制強靱化事業として令和6年度予算案:37億円の内数)を通じて、革新的な医療機
ドラインとして整備した。またガイダンスの策定領域を整備し、ルールインテリジェンス機能の運用を開始し策定プロセスの明確化 器開発に資するガイドラインについて、インテイリジェンス機能を通じて明確なプロセス
に努めた。また、先進的研究開発・開発体制強靱化事業のうち、令和3年度終了の国際規格向きのテーマ「内視鏡外科手術の の元で策定に努める。また、国際ルール形成・市場創造型標準化推進事業(令和6年
データベース構築に資する横断的基盤整備」を国際ルール形成・市場創造型標準化推進事業(令和5年度予算:22億円の内数) 度予算案:22億円の内数)を通じた医療機器関連のISO策定に協力する
に推薦し、採択に至った。
国際標準化において主導的な役割を果たすために行政のみならず産業界の協力が必要不可欠であり、産官学の連携 ・国際ルール形成・市場創造型標準化推進事業(令和5年度予算:22億円の内数)において、企業とアカデミアが連携し、医療動
の更なる強化に取り組む。[厚、◎経]
画の利活用促進に向けた管理規格に関する国際標準策定を目指して、活動を開始した。
・日本医療機器産業連合会の国際規格審議団体分科会に厚生労働省やPMDAが参加するなど、国際標準化に取り組んでいる
国内審議団体や医療機器業界と協力体制を構築した。
・引き続き、国際ルール形成・市場創造型標準化推進事業(令和6年度予算案:22億円 経済産業省医福室、
の内数)において、企業とアカデミアが連携し、医療動画の利活用促進に向けた管理 (厚労省医療機器審
規格に関する国際標準策定を目指して、活動を実施する。
査管理課)
・「医療機器国際標準化戦略推進事業」において国内審議団体への財政支援(補助率
1/2)を新たに実施するための費用も計上した予算を要求中。
・継続的な意見交換の場の設定など、医療機器業界との協力体制を構築し、国際標準
化議論において日本が主導的な役割を果たすための活動を、引き続き行っていく。
(3)「国民に必要な医療機器へのアクセシビリティの確保」に向けて
【国際展開に積極的に取り組む日本企業の増加】(再掲)
(上記参照)
【医療保険制度におけるイノベーションに対する適切な評価の実施】(再掲)
(上記参照)
【自然災害やパンデミック等の有事における安定供給の確保】
医療上必要不可欠な医療機器の明確化と当該機器の安定供給体制の確保
構築に向けて、まずは医療上必要不可欠な医療機器の明確化に取り組む。[◎厚、◎経]
・業界団体(一般社団法人日本医療機器産業連合会、一般社団法人日本臨床検査薬協会、日本医療機器テクノロジー協会、米 ・「医療機器等安定供給確保事業」にて、個別の供給不安等の案件において継続的な 経済産業省医福室、
国医療機器・IVD工業会、EBC医療機器・IVD委員会、一般社団法人日本医療機器販売業協会)及び製造販売業者や有識者へ 供給を行うための取組の検討を行う。
厚労省医療機器政策
協力を仰ぎながら、検討会及びWGを実施し医療機器等の安定供給の仕組みを検討を行った。
室
・「サプライチェーン実態把握等による医療機器安定供給確保事業」内にて、人工呼吸器、酸素濃縮装置、パルスオキシメータ、 ・「医療機器等安定供給確保事業」にて、必要に応じてサプライチェーン調査及び供給 経済産業省医福室、
チェーンの変化があり、医療機器の供給不安が生じることがある。サプライチェーンの変化に伴う供給不安の予防策を講 注射針、シリンジ、PCR検査装置、PCR検査試薬、抗原定性検査キットのサプライチェーン調査を行い、サプライチェーンの把握と 不安要因分析調査を行い、対応策について検討する。
厚労省医療機器政策
じることができるように、医療上必要不可欠な医療機器のサプライチェーンの実態の把握に向けて、仕組みの検討も含め 対応策について検討した。
室
て取り組む。[◎厚、◎経]
握したサプライチェーン上の問題を踏まえて、平時から供給力を高めることに取り組む。[◎厚、◎経]
・「医療機器等における先進的研究開発・開発体制強靭化事業(医療機器開発体制強靱化)」(令和5年度予算:40億円の内数)を ・引き続き「医療機器等における先進的研究開発・開発体制強靭化事業(医療機器開 経済産業省医福室、
通じて、感染症、各種災害等の非常事態において必要な医療機器、又は本邦の医療提供の維持に必要な医療機器であり、かつ 発体制強靱化)」(令和6年度予算案:37億円の内数)を通じて、感染症、各種災害等の 厚労省医療機器政策
海外からの供給途絶リスクがある医療機器の開発・改良を支援した。
非常事態において必要な医療機器、又は本邦の医療提供の維持に必要な医療機器 室
・「サプライチェーン実態把握等による医療機器安定供給確保事業」内にて、人工呼吸器、酸素濃縮装置、パルスオキシメータ、 であり、かつ海外からの供給途絶リスクがある医療機器の開発・改良を支援する。
注射針、シリンジ、PCR検査装置、PCR検査試薬、抗原定性検査キットの平時の供給力を把握し、供給力を高めるための対応策 ・「医療機器等安定供給確保事業」にて、調査対象品目の「感染症法等ガイドライン」
について検討した。
に基づき供給状況の把握に努めつつ、供給不安が生じた製品の対応及び代替品によ
る供給継続への対応を行う。
医療機器の供給不安について協議・検討する場の設置
その原因と解決の方向性について議論する場の構築に取り組む。[◎厚、◎経]
・「サプライチェーン実態把握等による医療機器安定供給確保事業」内にて、業界団体(一般社団法人日本医療機器産業連合
・「医療機器等安定供給確保事業」にて、供給不安が生じた場合に必要に応じ関係学 経済産業省医福室、
会、一般社団法人日本臨床検査薬協会、日本医療機器テクノロジー協会、米国医療機器・IVD工業会、EBC医療機器・IVD委員 会や当該製品の製造販売業者や代替品の製造販売業者が協議するための場を設定 厚労省医療機器政策
会、一般社団法人日本医療機器販売業協会)や製造販売業者、有識者、行政が医療機器等の安定供給について議論するため する。
室
の検討会を実施した。また個別の供給不安等の案件を解決するためのWGも設置した。
<有事における新規医療機器の早期実用化に向けた取組>(再掲)
・令和4年5月薬機法改正により、感染症拡大などの有事における医療機器の緊急承認制度を導入した。(対応済み)
組む。[◎厚]
4
(対応済み)
厚労省医療機器審査
管理課
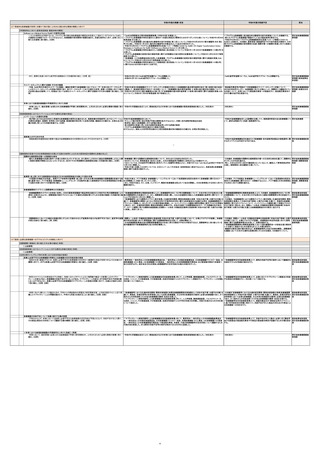
列3
令和5年度の実績・状況
令和6年度の取組予定
担当
(2)「革新的な医療機器が世界に先駆けて我が国に上市される魅力的な環境の構築」に向けて
【早期実用化に向けた薬事承認制度・審査体制の構築】
Software as a Medical Device(SaMD)の実用化促進
・「SaMD米国調査及び国内制度整備事業」(令和5年度)を実施した。
・「プログラム医療機器に係る優先的な審査等の試行的実施について」を継続する。
厚労省医療機器審査
の進捗を引き続きフォローアップするとともに、医療機器の研究開発の進展を踏まえ、迅速な実用化に向け、必要に応じて ・「プログラム医療機器の特性を踏まえた適切かつ迅速な承認及び開発のためのガイダンスの公表について」(令和5年5月29日 ・新たなプログラム医療機器の審査ポイント及び認証基準を策定する。
管理課
新たな支援策に取り組む。[◎厚]
事務連絡)を公表した。
・令和5年9月6日に「プログラム医療機器実用化促進パッケージ戦略2(DASH for
・「プログラム医療機器に係る優先的な審査等の試行的実施(第二回)について」(令和5年6月30日付け薬生機審発 0630 第2 SaMD2)」を踏まえ、引き続き、薬事承認・保険適用までの予見可能性の確保や、日本
号)を公表し、令和6年1月16日に優先的な審査等の対象品目として3品目の指定を行った。
発プログラム医療機器の研究開発の加速・国際市場への展開の推進に向けた取組み
・令和5年9月6日に「プログラム医療機器実用化促進パッケージ戦略2(DASH for SaMD:DX (Digital Transformation) Action
を継続する。
Strategies in Healthcare for SaMD (Software as a Medical Device) 2)」を公表した。
・「プログラム医療機器の特性を踏まえた二段階承認に係る取扱いについて」(令和5年11月16日付け医薬機審発1116第2号)を
公表した。
「プログラム医療機器の変更計画の確認申請に関する申請書及び添付資料の記載事例について」(令和5年12月22日付け事務
連絡)を公表した。
・「医療機器、人工知能関連技術を活用した医療機器、プログラム医療機器の変更計画の確認申請に関する質疑応答集(Q&
A)について」(令和5年12月22日付け事務連絡)を公表した。
・「プログラム医療機器の特性を踏まえた二段階承認に係る取扱いについて」(令和5年11月16日付け医薬機審発1116第2号)
に関するQ&Aを令和5年度中に公表予定。
・令和5年9月21日にSaMD産学官連携フォーラムを開催した。
・令和6年2月7日にSaMD産学官サブフォーラムを開催した。
・SaMD産学官連携フォーラム、SaMD産学官サブフォーラムを開催する。
サイバーセキュリティに関する規格・手引きの整備
今後、SaMD等の外部のネットワークと接続し、機能を発揮する医療機器においてはユーザーを含む各ステークホルダー ・令和5年度末の医療機器のサイバーセキュリティの確保を目的とした医療機器の基本要件基準の改正(第12条第3項の追加)
によるサイバーセキュリティの担保が重要であり、各ステークホルダーにおける責任分担等、現場への実装に向けて検討 に関連して、製造販売業者が対応すべき内容について、「医療機器の基本要件基準第 12 条第3項の適合性の確認について」
が必要な論点を整理しつつ、各製品において必要なサイバーセキュリティに関する規格や手引きの整備に取り組む。[◎ (令和5年5月23日付け薬生機審発0523第1号)や「医療機器の基本要件基準第 12 条第3項の適用に関する質疑応答集(Q&
厚]
A)について」(令和5年7月20日事務連絡)等で明確化した。
厚労省医療機器審査
管理課(経済産業省
医福室)
・製造販売業者等が実施すべき医療機器のサイバーセキュリティ対策について、
厚労省医療機器審査
SBOMの利活用やレガシー医療機器に向けた対策といった、国際的にも議論されてい 管理課・医薬安全対
る内容について、本邦においても製造販売業者への調査を行い、製造販売業者向け 策課
の手引書の改訂等を実施する。
有事における新規医療機器の早期実用化に向けた取組
有事において、臨床現場に必要とされる医療機器が早期に研究開発され、上市されるために必要な環境の整備に取り ・令和4年5月薬機法改正により、感染症拡大などの有事における医療機器の緊急承認制度を導入した。(対応済み)
組む。[◎厚]
【医療保険制度におけるイノベーションに対する適切な評価の実施】
イノベーションへの適切な評価
我が国におけるSaMDを含めた革新的な医療機器の実用化を進めるため、保険医療材料制度等におけるイノベーション 令和6年度診療報酬改定において、
の適切な評価を、画期性・有用性に対する評価、新規医療材料を用いた技術の評価、機能区分の細分化、合理化及び定 ・チャレンジ権の取得に係る申請が可能な期間を拡大するとともに、対象に体外診断用医薬品を追加
義の見直し等により引き続き推進する。[◎厚]
・経済性に優れた医療機器に対する評価の新設
・希少疾病等の検査に用いる体外診断用医薬品等に対する評価の新設
・プログラム医療機器の特性を踏まえた制度の見直し
を行うとともに、臨床上の有用性等を踏まえた特定保険医療材料の機能区分の細分化・合理化等を実施した。
(対応済み)
厚労省医療機器審査
管理課
・令和6年診療報酬改定による影響を注視しつつ、保険適用希望のある医療機器につ 厚労省医療課
いて、適切な評価を行い迅速に保険適用する。
保険導入の手引きの作成
・令和6年度診療報酬改定を踏まえた「医療機器・体外診断用医薬品の保険適用に関 厚労省医療機器政策
するガイドブック」を作成する予定である。
室
-
【規制調和の促進や日本を参照国制度の対象とする国の充実等による日本の薬事承認の国際的な意義の向上】
国際的な規制調和活動への積極的な参加
優れた医療機器の迅速な国内への導入を図れるようにするため、また国内に上市された製品を国際展開しようとした際 ・医療機器に関する国際的な規制調和活動について、次のとおり主体的な対応を行った。
・引き続き、医療機器の国際的な規制調和の場への主体的な参加を通じて、国際的な 厚労省医療機器審査
に他国の規制が障壁とならないようにするため、IMDRFやHBD等国際的な規制調和活動に引き続き取り組む。[◎厚]
・IMDRFについては、管理委員会・各WGに出席し、日本の規制基準が国際的に活用されるよう活動を行った。
ガイダンスの作成を進める。
管理課・国際薬事規
・HBDについては、日米産官学の関係者と毎月オンライン会議等の実施とともに、対面でのThink Tank Meetingを東京で令和5年 ・特に、日本は2025年にIMDRF議長国となっているところ、議長として管理委員会等を 制室
12月14日に開催した。
主催し、規制調和に係る議論を主導していく。
・令和4年度に加盟したGHWPについては、正式メンバーとして年次会合・技術委員会に参加するとともに、他参加国と医療機器
規制に関する意見交換を行った。
新興国・途上国に対する規制調和の促進及び日本を参照国制度の対象とする国の充実
中長期の市場拡大を考慮し、東南アジア地域等の新興国・途上国への日本企業の医療機器の国際展開を促進する取 ・令和5年度は、アジア医薬品・医療機器トレーニングセンターにおいて各国規制当局担当者向けに医療機器に関するセミナー ・引き続き、アジア医薬品・医療機器トレーニングセンターにおいて各国規制当局担当 厚労省医療機器審査
組も重要であり、アジア医薬品・医療機器トレーニングセンターの活動等を通じた規制調和や日本を参照国制度の対象と を3回開催した(対面1回、オンライン2回)。
者向けに医療機器に関するセミナーを開催するとともに、アジア諸国と日本を参照国と 管理課、国際薬事規
する国の充実に向けて引き続き取り組む。[◎厚]
・また、令和5年度は、タイ、台湾、インドネシア、韓国の医療機器当局とのバイ会合を開催し、日本を参照国とする対応に向けた する対応に向けた調整を進める。
制室
議論を進めた。
医療機器開発ガイドラインと国際標準化の活動強化
医療機器開発ガイドラインを有効に活用し、日本の薬事承認審査や製品特性を踏まえた内容がISO等の国際規格により ・「医療機器国際標準化戦略推進事業」により、医療機器等のISO/IEC等の国際規格について、日本の考え方が反映された規 ・「医療機器国際標準化戦略推進事業」により、引き続き、医療機器等のISO/IEC等 経済産業省医福室、
適切に反映されるように、国際規格の策定プロセスにおいて主導的な役割を果たすための体制の整備に引き続き取り組 格の国際標準化の促進を行った。また、国際標準化推進に関し、ASEAN加盟国を対象とした医療機器の基準等に関するワーク の国際規格について、日本の考え方が反映された規格の国際標準化等の促進を行っ 厚労省医療機器審査
む。[◎厚、◎経]
ショップを令和5年12月4日に開催した。
ていく。
管理課
・「医療機器等における開発ガイドライン策定事業」(先進的研究開発・開発体制強靱化事業 令和5年度予算:40億円の内数)を ・引き続き、「医療機器等における開発ガイドライン策定事業」(先進的研究開発・開発
通じて、医療機器等の開発における工学的安定性や生物学的安定性に関する各評価項目の試験方法等を、医療機器開発ガイ 体制強靱化事業として令和6年度予算案:37億円の内数)を通じて、革新的な医療機
ドラインとして整備した。またガイダンスの策定領域を整備し、ルールインテリジェンス機能の運用を開始し策定プロセスの明確化 器開発に資するガイドラインについて、インテイリジェンス機能を通じて明確なプロセス
に努めた。また、先進的研究開発・開発体制強靱化事業のうち、令和3年度終了の国際規格向きのテーマ「内視鏡外科手術の の元で策定に努める。また、国際ルール形成・市場創造型標準化推進事業(令和6年
データベース構築に資する横断的基盤整備」を国際ルール形成・市場創造型標準化推進事業(令和5年度予算:22億円の内数) 度予算案:22億円の内数)を通じた医療機器関連のISO策定に協力する
に推薦し、採択に至った。
国際標準化において主導的な役割を果たすために行政のみならず産業界の協力が必要不可欠であり、産官学の連携 ・国際ルール形成・市場創造型標準化推進事業(令和5年度予算:22億円の内数)において、企業とアカデミアが連携し、医療動
の更なる強化に取り組む。[厚、◎経]
画の利活用促進に向けた管理規格に関する国際標準策定を目指して、活動を開始した。
・日本医療機器産業連合会の国際規格審議団体分科会に厚生労働省やPMDAが参加するなど、国際標準化に取り組んでいる
国内審議団体や医療機器業界と協力体制を構築した。
・引き続き、国際ルール形成・市場創造型標準化推進事業(令和6年度予算案:22億円 経済産業省医福室、
の内数)において、企業とアカデミアが連携し、医療動画の利活用促進に向けた管理 (厚労省医療機器審
規格に関する国際標準策定を目指して、活動を実施する。
査管理課)
・「医療機器国際標準化戦略推進事業」において国内審議団体への財政支援(補助率
1/2)を新たに実施するための費用も計上した予算を要求中。
・継続的な意見交換の場の設定など、医療機器業界との協力体制を構築し、国際標準
化議論において日本が主導的な役割を果たすための活動を、引き続き行っていく。
(3)「国民に必要な医療機器へのアクセシビリティの確保」に向けて
【国際展開に積極的に取り組む日本企業の増加】(再掲)
(上記参照)
【医療保険制度におけるイノベーションに対する適切な評価の実施】(再掲)
(上記参照)
【自然災害やパンデミック等の有事における安定供給の確保】
医療上必要不可欠な医療機器の明確化と当該機器の安定供給体制の確保
構築に向けて、まずは医療上必要不可欠な医療機器の明確化に取り組む。[◎厚、◎経]
・業界団体(一般社団法人日本医療機器産業連合会、一般社団法人日本臨床検査薬協会、日本医療機器テクノロジー協会、米 ・「医療機器等安定供給確保事業」にて、個別の供給不安等の案件において継続的な 経済産業省医福室、
国医療機器・IVD工業会、EBC医療機器・IVD委員会、一般社団法人日本医療機器販売業協会)及び製造販売業者や有識者へ 供給を行うための取組の検討を行う。
厚労省医療機器政策
協力を仰ぎながら、検討会及びWGを実施し医療機器等の安定供給の仕組みを検討を行った。
室
・「サプライチェーン実態把握等による医療機器安定供給確保事業」内にて、人工呼吸器、酸素濃縮装置、パルスオキシメータ、 ・「医療機器等安定供給確保事業」にて、必要に応じてサプライチェーン調査及び供給 経済産業省医福室、
チェーンの変化があり、医療機器の供給不安が生じることがある。サプライチェーンの変化に伴う供給不安の予防策を講 注射針、シリンジ、PCR検査装置、PCR検査試薬、抗原定性検査キットのサプライチェーン調査を行い、サプライチェーンの把握と 不安要因分析調査を行い、対応策について検討する。
厚労省医療機器政策
じることができるように、医療上必要不可欠な医療機器のサプライチェーンの実態の把握に向けて、仕組みの検討も含め 対応策について検討した。
室
て取り組む。[◎厚、◎経]
握したサプライチェーン上の問題を踏まえて、平時から供給力を高めることに取り組む。[◎厚、◎経]
・「医療機器等における先進的研究開発・開発体制強靭化事業(医療機器開発体制強靱化)」(令和5年度予算:40億円の内数)を ・引き続き「医療機器等における先進的研究開発・開発体制強靭化事業(医療機器開 経済産業省医福室、
通じて、感染症、各種災害等の非常事態において必要な医療機器、又は本邦の医療提供の維持に必要な医療機器であり、かつ 発体制強靱化)」(令和6年度予算案:37億円の内数)を通じて、感染症、各種災害等の 厚労省医療機器政策
海外からの供給途絶リスクがある医療機器の開発・改良を支援した。
非常事態において必要な医療機器、又は本邦の医療提供の維持に必要な医療機器 室
・「サプライチェーン実態把握等による医療機器安定供給確保事業」内にて、人工呼吸器、酸素濃縮装置、パルスオキシメータ、 であり、かつ海外からの供給途絶リスクがある医療機器の開発・改良を支援する。
注射針、シリンジ、PCR検査装置、PCR検査試薬、抗原定性検査キットの平時の供給力を把握し、供給力を高めるための対応策 ・「医療機器等安定供給確保事業」にて、調査対象品目の「感染症法等ガイドライン」
について検討した。
に基づき供給状況の把握に努めつつ、供給不安が生じた製品の対応及び代替品によ
る供給継続への対応を行う。
医療機器の供給不安について協議・検討する場の設置
その原因と解決の方向性について議論する場の構築に取り組む。[◎厚、◎経]
・「サプライチェーン実態把握等による医療機器安定供給確保事業」内にて、業界団体(一般社団法人日本医療機器産業連合
・「医療機器等安定供給確保事業」にて、供給不安が生じた場合に必要に応じ関係学 経済産業省医福室、
会、一般社団法人日本臨床検査薬協会、日本医療機器テクノロジー協会、米国医療機器・IVD工業会、EBC医療機器・IVD委員 会や当該製品の製造販売業者や代替品の製造販売業者が協議するための場を設定 厚労省医療機器政策
会、一般社団法人日本医療機器販売業協会)や製造販売業者、有識者、行政が医療機器等の安定供給について議論するため する。
室
の検討会を実施した。また個別の供給不安等の案件を解決するためのWGも設置した。
<有事における新規医療機器の早期実用化に向けた取組>(再掲)
・令和4年5月薬機法改正により、感染症拡大などの有事における医療機器の緊急承認制度を導入した。(対応済み)
組む。[◎厚]
4
(対応済み)
厚労省医療機器審査
管理課