よむ、つかう、まなぶ。
参考資料 (1 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00032.html |
| 出典情報 | 医薬・生活衛生局が実施する検討会 医療上の必要性の高い未承認薬・適応外薬検討会議(第58回 3/21)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
参考資料 1
「医療上の必要性の高い未承認薬・適応外薬検討会議」開催要綱
厚生労働省医政局研究開発政策課
厚生労働省医薬局医薬品審査管理課
1.目的
○ 国内では承認されていない医薬品や適応(以下「未承認薬・適応外薬」という。
)について、
① 欧米での承認実績や論文等で公表された優れた試験成績等のエビデンスに基づいて医療上の
必要性を評価するとともに、
② 公知申請への該当性や承認申請のために追加で実施が必要な試験の妥当性を確認すること、
③ また、これまでに得られている治験薬のエビデンスに基づき、既存の治療薬がない及び対象
とする疾患の重篤性の観点から、人道的見地から実施される治験への該当性について確認す
ること、
④ 特定の用途における医療上のニーズが著しく充足されていないこと及びその用途の使用価値
を評価すること
等により、製薬企業による未承認薬・適応外薬の開発を促進するとともに、新薬の開発を阻害す
ることなく、新たな革新的な新薬による治療機会の改善に資することを目的とする。
2.検討事項
(1)医療上の必要性
・生命に重大な影響がある疾患である等、適応疾患が重篤であること
・当該疾患に係る既存の療法が国内にない等、医療上の有用性があること
のいずれにも該当するか否かを検討する。
(2)公知申請への該当性及び追加実施が必要な試験
医療上の必要性が高いと評価された未承認薬・適応外薬について、公知申請への該当性や
承認申請のために追加で実施が必要な試験の妥当性を確認する。
(3)人道的見地から実施される治験への制度該当性の確認
新たに開始の要望がある人道的見地から実施される治験について、その制度該当性基準で
ある生命に重大な影響がある重篤な疾患であって、既存の治療法に有効なものが存在しない
未承認又は適応外の治療薬であることへの該当性を確認する。
(4)特定用途医薬品への該当性
開発が要望又は提案された特定用途医薬品の候補となる医薬品について、特定用途医薬品
の指定基準への該当性を評価する。
(5)その他
製薬企業が開発を行う医療上の必要性が高い未承認薬・適応外薬について、定期的
に開発進捗状況を確認する。
その他、必要な事項の検討を行う。
3.構成員
○ 検討会議は、薬物療法に関する医学的・薬学的な学識経験を有する者で構成し、各疾患領域に
対応する。
○ 検討会議は、構成員のうち1人を座長として選出する。
4.運営
○ 検討会議は、年4回を目途に開催するが、必要に応じて随時開催することができる。
○ 検討会議は、知的財産権等に係る事項を除き、原則公開するとともに、議事録を作成・公表す
る。
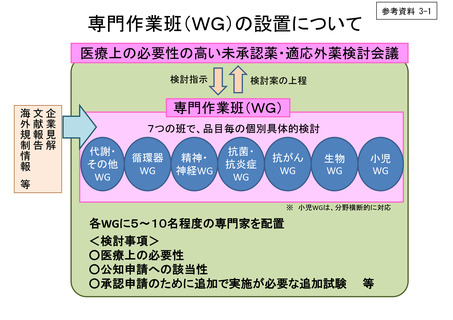
○ 検討会議は、検討事項について具体的な調査を行うため、各疾患領域に係る専門家からなる専
1 / 15
「医療上の必要性の高い未承認薬・適応外薬検討会議」開催要綱
厚生労働省医政局研究開発政策課
厚生労働省医薬局医薬品審査管理課
1.目的
○ 国内では承認されていない医薬品や適応(以下「未承認薬・適応外薬」という。
)について、
① 欧米での承認実績や論文等で公表された優れた試験成績等のエビデンスに基づいて医療上の
必要性を評価するとともに、
② 公知申請への該当性や承認申請のために追加で実施が必要な試験の妥当性を確認すること、
③ また、これまでに得られている治験薬のエビデンスに基づき、既存の治療薬がない及び対象
とする疾患の重篤性の観点から、人道的見地から実施される治験への該当性について確認す
ること、
④ 特定の用途における医療上のニーズが著しく充足されていないこと及びその用途の使用価値
を評価すること
等により、製薬企業による未承認薬・適応外薬の開発を促進するとともに、新薬の開発を阻害す
ることなく、新たな革新的な新薬による治療機会の改善に資することを目的とする。
2.検討事項
(1)医療上の必要性
・生命に重大な影響がある疾患である等、適応疾患が重篤であること
・当該疾患に係る既存の療法が国内にない等、医療上の有用性があること
のいずれにも該当するか否かを検討する。
(2)公知申請への該当性及び追加実施が必要な試験
医療上の必要性が高いと評価された未承認薬・適応外薬について、公知申請への該当性や
承認申請のために追加で実施が必要な試験の妥当性を確認する。
(3)人道的見地から実施される治験への制度該当性の確認
新たに開始の要望がある人道的見地から実施される治験について、その制度該当性基準で
ある生命に重大な影響がある重篤な疾患であって、既存の治療法に有効なものが存在しない
未承認又は適応外の治療薬であることへの該当性を確認する。
(4)特定用途医薬品への該当性
開発が要望又は提案された特定用途医薬品の候補となる医薬品について、特定用途医薬品
の指定基準への該当性を評価する。
(5)その他
製薬企業が開発を行う医療上の必要性が高い未承認薬・適応外薬について、定期的
に開発進捗状況を確認する。
その他、必要な事項の検討を行う。
3.構成員
○ 検討会議は、薬物療法に関する医学的・薬学的な学識経験を有する者で構成し、各疾患領域に
対応する。
○ 検討会議は、構成員のうち1人を座長として選出する。
4.運営
○ 検討会議は、年4回を目途に開催するが、必要に応じて随時開催することができる。
○ 検討会議は、知的財産権等に係る事項を除き、原則公開するとともに、議事録を作成・公表す
る。
○ 検討会議は、検討事項について具体的な調査を行うため、各疾患領域に係る専門家からなる専
1 / 15