よむ、つかう、まなぶ。
03【資料1】感染症危機対応医薬品等の利用可能性確保に関する検討会について (4 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24678.html |
| 出典情報 | 厚生科学審議会 予防接種・ワクチン分科会 研究開発及び生産・流通部会(第27回 3/23)《厚生労働省》 |
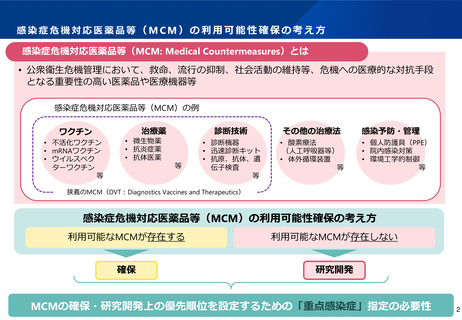
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
ワクチン開発・生産体制強化戦略(概要)
ワクチンを国内で開発・生産出来る力を持つことは、国民の健康保持への寄与はもとより、外交や安全保障の観点からも極めて重要
今回のパンデミックを契機に、我が国においてワクチン開発を滞らせた要因を明らかにし、解決に向けて国を挙げて取り組むため、政府が
一体となって必要な体制を再構築し、長期継続的に取り組む国家戦略としてまとめたもの
研究開発・生産体制等の課題
ワクチンの迅速な開発・供給を可能にする体制の構築のために必要な政策
• 最新のワクチン開発が可能な研
究機関の機能、人材、産学連携
の不足
①世界トップレベルの研究開発拠点形成<フラッグシップ拠点を形成>
• ワクチン開発の拠点を形成、臨床及び産業界と連携し、分野横断的な研究や、新規モダリティを活用
②戦略性を持った研究費のファンディング機能の強化〈先進的研究開発センターをAMEDに新設・機能強化〉
• 産業界の研究開発状況、国内外の新規モダリティ動向を踏まえ、ワクチン実用化に向け政府と一体と
なって戦略的な研究費配分を行う体制をAMEDに新設
③治験環境の整備・拡充<国内外治験の充実・迅速化>
• 臨床研究中核病院の緊急時治験の要件化や治験病床等の平時からの確保
• アジア地域の臨床研究・治験ネットワークを充実
④薬事承認プロセスの迅速化と基準整備
• 新たな感染症に備えて、あらかじめ臨床試験の枠組みに関する手順を作成
• 緊急事態に使用を認めるための制度の在り方を検討
• ワクチン開発への戦略的な研究
費配分の不足
• 輸入ワクチンを含め迅速で予見
可能性を高める薬事承認の在り
方等
• 特に第Ⅲ相試験をめぐる治験実
施の困難性
• ワクチン製造設備投資のリスク
• シーズ開発やそれを実用化に
結び付けるベンチャー企業、リ
スクマネー供給主体の不足
• ワクチン開発・生産を担う国内
産業の脆弱性
• 企業による研究開発投資の回
収見通しの困難性
⑤ワクチン製造拠点の整備<平時にも緊急時にも活用できる製造設備の整備>
• ワクチンとバイオ医薬品の両用性(デュアルユース設備)とする施設整備、改修支援
⑥創薬ベンチャーの育成<創薬ベンチャーエコシステム全体の底上げ>
• 創薬ベンチャーにとって特にリスクの大きな第Ⅱ相試験までの実用化開発支援等
⑦ワクチン開発・製造産業の育成・振興
• 新たな感染症発生時の国によるワクチン買上げなど国内でのワクチン供給が円滑に進むよう検討、
国際的枠組みを通じた世界的供給やODAの活用等を検討
• ワクチンの開発企業支援、原材料の国産化、備蓄等を担う体制を厚生労働省に構築
⑧国際協調の推進
• ワクチン開発、供給、薬事承認の規制調和の国際的合意形成、COVAX等への貢献
⑨ワクチン開発の前提としてのモニタリング体制の強化
以上を実現するため研究開発を超えた総合的な司令塔機能や関係閣僚での議論の場を構築すべき
喫緊の新型コロナウイルス感染症への対応
• 第Ⅲ相試験の被験者確保の困難性等に対応するため、薬事承認はICMRA(薬事規制当局国際連携組織)の議論を踏まえ、コンセンサ
スを先取りし、検証試験を開始・速やかに完了できるよう強力に支援
• 国産ワクチンの検証試験加速のため、臨床研究中核病院の機能拡充に加え、臨床試験受託機関等も活用 等
3
ワクチンを国内で開発・生産出来る力を持つことは、国民の健康保持への寄与はもとより、外交や安全保障の観点からも極めて重要
今回のパンデミックを契機に、我が国においてワクチン開発を滞らせた要因を明らかにし、解決に向けて国を挙げて取り組むため、政府が
一体となって必要な体制を再構築し、長期継続的に取り組む国家戦略としてまとめたもの
研究開発・生産体制等の課題
ワクチンの迅速な開発・供給を可能にする体制の構築のために必要な政策
• 最新のワクチン開発が可能な研
究機関の機能、人材、産学連携
の不足
①世界トップレベルの研究開発拠点形成<フラッグシップ拠点を形成>
• ワクチン開発の拠点を形成、臨床及び産業界と連携し、分野横断的な研究や、新規モダリティを活用
②戦略性を持った研究費のファンディング機能の強化〈先進的研究開発センターをAMEDに新設・機能強化〉
• 産業界の研究開発状況、国内外の新規モダリティ動向を踏まえ、ワクチン実用化に向け政府と一体と
なって戦略的な研究費配分を行う体制をAMEDに新設
③治験環境の整備・拡充<国内外治験の充実・迅速化>
• 臨床研究中核病院の緊急時治験の要件化や治験病床等の平時からの確保
• アジア地域の臨床研究・治験ネットワークを充実
④薬事承認プロセスの迅速化と基準整備
• 新たな感染症に備えて、あらかじめ臨床試験の枠組みに関する手順を作成
• 緊急事態に使用を認めるための制度の在り方を検討
• ワクチン開発への戦略的な研究
費配分の不足
• 輸入ワクチンを含め迅速で予見
可能性を高める薬事承認の在り
方等
• 特に第Ⅲ相試験をめぐる治験実
施の困難性
• ワクチン製造設備投資のリスク
• シーズ開発やそれを実用化に
結び付けるベンチャー企業、リ
スクマネー供給主体の不足
• ワクチン開発・生産を担う国内
産業の脆弱性
• 企業による研究開発投資の回
収見通しの困難性
⑤ワクチン製造拠点の整備<平時にも緊急時にも活用できる製造設備の整備>
• ワクチンとバイオ医薬品の両用性(デュアルユース設備)とする施設整備、改修支援
⑥創薬ベンチャーの育成<創薬ベンチャーエコシステム全体の底上げ>
• 創薬ベンチャーにとって特にリスクの大きな第Ⅱ相試験までの実用化開発支援等
⑦ワクチン開発・製造産業の育成・振興
• 新たな感染症発生時の国によるワクチン買上げなど国内でのワクチン供給が円滑に進むよう検討、
国際的枠組みを通じた世界的供給やODAの活用等を検討
• ワクチンの開発企業支援、原材料の国産化、備蓄等を担う体制を厚生労働省に構築
⑧国際協調の推進
• ワクチン開発、供給、薬事承認の規制調和の国際的合意形成、COVAX等への貢献
⑨ワクチン開発の前提としてのモニタリング体制の強化
以上を実現するため研究開発を超えた総合的な司令塔機能や関係閣僚での議論の場を構築すべき
喫緊の新型コロナウイルス感染症への対応
• 第Ⅲ相試験の被験者確保の困難性等に対応するため、薬事承認はICMRA(薬事規制当局国際連携組織)の議論を踏まえ、コンセンサ
スを先取りし、検証試験を開始・速やかに完了できるよう強力に支援
• 国産ワクチンの検証試験加速のため、臨床研究中核病院の機能拡充に加え、臨床試験受託機関等も活用 等
3