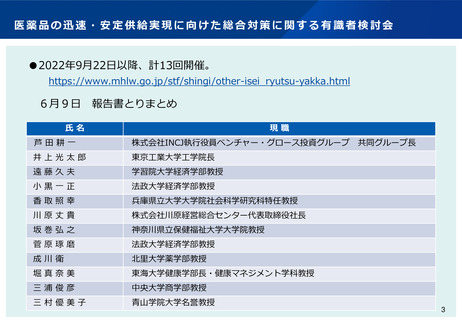
よむ、つかう、まなぶ。
【資料2】創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会(概要)(医薬局提出資料)[1.5MB] (16 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_41120.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第16回 7/4)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
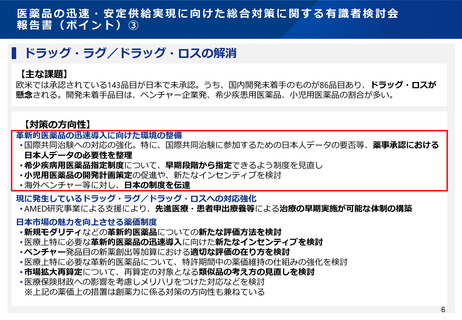
小児用医薬品の開発促進(開発計画の策定)
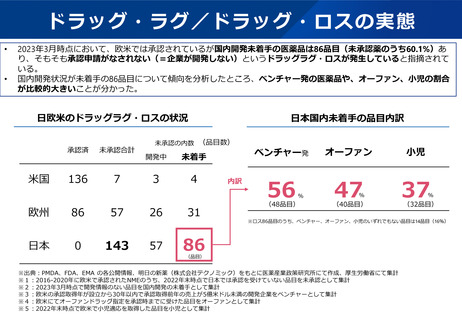
⚫ 小児用医薬品の開発は、日本だけでなく国際的にも、市場規模が小さいことや治験実施の困難さ(症例集積性、コスト)等の理由から、
一般的に開発が進みにくいことが指摘されている。
⚫ 欧米では、その対策の一つとして、成人の医薬品開発時に小児用医薬品の開発計画策定を義務づける等の取組を行っている。
⚫ 欧米の制度を参考にしつつ、我が国の状況も踏まえながら、小児用医薬品開発を成人用と同時に進めるための仕組みや、その実効性を
高めるための対応について、令和5年7月10日の創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会において
検討を行い、その結果を踏まえ関連通知・QAを発出した。
・「成人を対象とした医薬品の開発期間中に行う小児用医薬品の開発計画の策定について」(令和6年1月12日医薬薬審発 0112 第3号厚生労働省医薬局医薬品審査管理課長通知)
・「成人を対象とした医薬品の開発期間中に行う小児用医薬品の開発計画の策定について」の一部改正について(令和6年3月29日医薬薬審発0329第1号厚生労働省医薬局医薬品審査管理課長通知)
・成人を対象とした医薬品の開発期間中に行う小児用医薬品の開発計画の作成についての質疑応答集(Q&A)について(令和6年3月29日厚生労働省医薬局医薬品審査管理課事務連絡)
▍通知の内容
本通知の対象となる小児用医薬品の開発
基本的な考え方
• 医 療 上 の 必 要 性 に 基 づ き 、 以 下 の ( 1 ) か ら • 成人を対象とした医薬品の開発を行う場合は、当
(3)のいずれか又は複数に該当する開発を行う
該開発の対象となる効能・効果に係る小児用医薬
品の開発計画を策定し、成人を対象とした医薬品
場合を指す。
の承認申請を行うまでに、PMDAの確認を受ける
(1)効能・効果において成人と小児が区別され
とともに、遅滞なく当該開発計画に基づいて開発
る医薬品において効能・効果の対象に小児を含め
を進めることが望ましい。
るために行う開発
• 成人を対象とした医薬品の承認申請を行うまでに
(2)小児における適切 な用法・用量を設定する
PMDAの確認を受けることが困難である場合は、
ために行う開発
当該承認申請に対する審査終了までの間にPMDA
(3)成人用とは異なる小児用の剤形の開発
の確認を受けるとともに、遅滞なく当該開発計画
に基づいて開発を進めることが望ましい。
その他
• 小児における適切な用法・用量を設定するため
の開発計画については、日本人小児を対象とし
た治験の実施を検討するだけではなく、成人の
データや海外の小児のデータ、リアルワールド
データ、モデリング&シミュレーションの活用
等も検討した上で、PMDAの確認を受けること。
• 成人用とは異なる小児用の剤形の開発について、
開発に長期間を要することが想定されることか
ら、その点も考慮した開発計画について、
PMDAの確認を受けること。
▍薬価上の取扱い
• PMDAの確認を受けた開発計画に基づき開発を進めた結果、小児の適応が承認された場合には、薬価収載時、薬価改定時及び市場拡大再算定適応時における
小児加算率をより高く評価する。
⚫ 小児用医薬品の開発は、日本だけでなく国際的にも、市場規模が小さいことや治験実施の困難さ(症例集積性、コスト)等の理由から、
一般的に開発が進みにくいことが指摘されている。
⚫ 欧米では、その対策の一つとして、成人の医薬品開発時に小児用医薬品の開発計画策定を義務づける等の取組を行っている。
⚫ 欧米の制度を参考にしつつ、我が国の状況も踏まえながら、小児用医薬品開発を成人用と同時に進めるための仕組みや、その実効性を
高めるための対応について、令和5年7月10日の創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会において
検討を行い、その結果を踏まえ関連通知・QAを発出した。
・「成人を対象とした医薬品の開発期間中に行う小児用医薬品の開発計画の策定について」(令和6年1月12日医薬薬審発 0112 第3号厚生労働省医薬局医薬品審査管理課長通知)
・「成人を対象とした医薬品の開発期間中に行う小児用医薬品の開発計画の策定について」の一部改正について(令和6年3月29日医薬薬審発0329第1号厚生労働省医薬局医薬品審査管理課長通知)
・成人を対象とした医薬品の開発期間中に行う小児用医薬品の開発計画の作成についての質疑応答集(Q&A)について(令和6年3月29日厚生労働省医薬局医薬品審査管理課事務連絡)
▍通知の内容
本通知の対象となる小児用医薬品の開発
基本的な考え方
• 医 療 上 の 必 要 性 に 基 づ き 、 以 下 の ( 1 ) か ら • 成人を対象とした医薬品の開発を行う場合は、当
(3)のいずれか又は複数に該当する開発を行う
該開発の対象となる効能・効果に係る小児用医薬
品の開発計画を策定し、成人を対象とした医薬品
場合を指す。
の承認申請を行うまでに、PMDAの確認を受ける
(1)効能・効果において成人と小児が区別され
とともに、遅滞なく当該開発計画に基づいて開発
る医薬品において効能・効果の対象に小児を含め
を進めることが望ましい。
るために行う開発
• 成人を対象とした医薬品の承認申請を行うまでに
(2)小児における適切 な用法・用量を設定する
PMDAの確認を受けることが困難である場合は、
ために行う開発
当該承認申請に対する審査終了までの間にPMDA
(3)成人用とは異なる小児用の剤形の開発
の確認を受けるとともに、遅滞なく当該開発計画
に基づいて開発を進めることが望ましい。
その他
• 小児における適切な用法・用量を設定するため
の開発計画については、日本人小児を対象とし
た治験の実施を検討するだけではなく、成人の
データや海外の小児のデータ、リアルワールド
データ、モデリング&シミュレーションの活用
等も検討した上で、PMDAの確認を受けること。
• 成人用とは異なる小児用の剤形の開発について、
開発に長期間を要することが想定されることか
ら、その点も考慮した開発計画について、
PMDAの確認を受けること。
▍薬価上の取扱い
• PMDAの確認を受けた開発計画に基づき開発を進めた結果、小児の適応が承認された場合には、薬価収載時、薬価改定時及び市場拡大再算定適応時における
小児加算率をより高く評価する。