よむ、つかう、まなぶ。
【資料2】創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会(概要)(医薬局提出資料)[1.5MB] (17 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_41120.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第16回 7/4)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
海外開発先行品の国際共同治験前の日本人第1相試験は原則不要へ
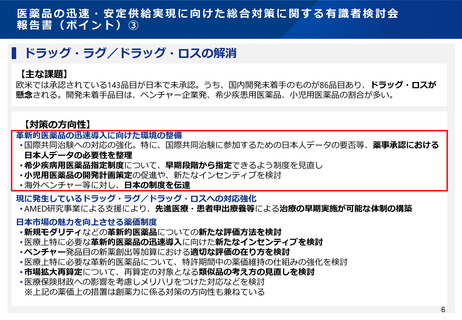
基本的考え方
⚫ 海外で先行して早期の臨床開発が進められ、その
後の国際共同治験が実施される段階において日本
の参加の検討が始まった医薬品では、国際共同治
験への日本人の参加の可否がその後の日本での当
該医薬品の導入の成否に大きく影響する可能性が
ある。
⚫ 国際共同治験に参加する日本人の安全性を確保す
るとともに、当該医薬品の導入が日本で遅れるこ
とによる患者の不利益を最小化する観点から、国
際共同治験の開始前における日本人での第Ⅰ相試
験の実施に関する基本的な考え方をとりまとめ、
通知※を発出した。
※「海外で臨床開発が先行した医薬品の国際共同治験開始前
の日本人での第Ⅰ相試験の実施に関する基本的考え方につ
いて」(令和5年12月25日医薬薬審発1225第2号厚生労
働省医薬局医薬品審査管理課長通知)
• 国際共同治験開始前の第Ⅰ相試験については、人種・民族や国・地域ごとに実施すること
が必須となるものではない。利用可能なデータから日本人治験参加者の安全性等を検討し、
必要な場合を除いて原則として不要。
• 一方、医療機関への情報提供等の観点から、第1相試験を国際共同として実施する場合に
はそれに日本が参加するなど、可能な限り日本人における薬物動態等に関する情報を収集
することが望ましい。
個別品目における判断の考え方
• 希少疾患、難治性かつ重篤な疾患又は小児(成人開発の有無を問わない。)に用いる医薬
品などのアンメットメディカルニーズが高いものについては、適切なインフォームドコン
セントを得た上で、日本人第Ⅰ相試験を実施せずとも国際共同治験に参加できる。
• それ以外の品目についても、非臨床データや複数の人種での海外試験の結果等から、日本
人治験参加者の安全性が許容可能である場合には、実施不要。一方、患者数が多く、第Ⅰ
相試験を実施する時間が十分にある場合は、実施を検討すべき。ただし、日本人における
リスクが外国人におけるリスクを大きく上回らないと判断できる場合などは、この限りで
はない。
• 例えば抗がん剤などでみられるような、重篤な有害事象が高頻度に発現する医薬品であり、
かつ、日本人での投与経験が少ないなど安全性情報が限られている医薬品については、日
本人第Ⅰ相試験の要否についてより慎重に判断する必要がある。
その他
• 日本人第Ⅰ相試験の実施の有無にかかわらず、承認申請までの間に、薬物動態・薬力学の
国内外差の検討を行うことが重要である。
⚫ なお、本通知の内容は英訳を作成・公表しており、
海外ベンチャー企業に向けて情報発信していく。
• 治験依頼者が必要と判断した場合には、国際共同治験において、日本人に対する追加の安
全確保策を設定する。
• 最終的には、PMDAは治験相談等において必要な指示又は助言を行う場合がある。
基本的考え方
⚫ 海外で先行して早期の臨床開発が進められ、その
後の国際共同治験が実施される段階において日本
の参加の検討が始まった医薬品では、国際共同治
験への日本人の参加の可否がその後の日本での当
該医薬品の導入の成否に大きく影響する可能性が
ある。
⚫ 国際共同治験に参加する日本人の安全性を確保す
るとともに、当該医薬品の導入が日本で遅れるこ
とによる患者の不利益を最小化する観点から、国
際共同治験の開始前における日本人での第Ⅰ相試
験の実施に関する基本的な考え方をとりまとめ、
通知※を発出した。
※「海外で臨床開発が先行した医薬品の国際共同治験開始前
の日本人での第Ⅰ相試験の実施に関する基本的考え方につ
いて」(令和5年12月25日医薬薬審発1225第2号厚生労
働省医薬局医薬品審査管理課長通知)
• 国際共同治験開始前の第Ⅰ相試験については、人種・民族や国・地域ごとに実施すること
が必須となるものではない。利用可能なデータから日本人治験参加者の安全性等を検討し、
必要な場合を除いて原則として不要。
• 一方、医療機関への情報提供等の観点から、第1相試験を国際共同として実施する場合に
はそれに日本が参加するなど、可能な限り日本人における薬物動態等に関する情報を収集
することが望ましい。
個別品目における判断の考え方
• 希少疾患、難治性かつ重篤な疾患又は小児(成人開発の有無を問わない。)に用いる医薬
品などのアンメットメディカルニーズが高いものについては、適切なインフォームドコン
セントを得た上で、日本人第Ⅰ相試験を実施せずとも国際共同治験に参加できる。
• それ以外の品目についても、非臨床データや複数の人種での海外試験の結果等から、日本
人治験参加者の安全性が許容可能である場合には、実施不要。一方、患者数が多く、第Ⅰ
相試験を実施する時間が十分にある場合は、実施を検討すべき。ただし、日本人における
リスクが外国人におけるリスクを大きく上回らないと判断できる場合などは、この限りで
はない。
• 例えば抗がん剤などでみられるような、重篤な有害事象が高頻度に発現する医薬品であり、
かつ、日本人での投与経験が少ないなど安全性情報が限られている医薬品については、日
本人第Ⅰ相試験の要否についてより慎重に判断する必要がある。
その他
• 日本人第Ⅰ相試験の実施の有無にかかわらず、承認申請までの間に、薬物動態・薬力学の
国内外差の検討を行うことが重要である。
⚫ なお、本通知の内容は英訳を作成・公表しており、
海外ベンチャー企業に向けて情報発信していく。
• 治験依頼者が必要と判断した場合には、国際共同治験において、日本人に対する追加の安
全確保策を設定する。
• 最終的には、PMDAは治験相談等において必要な指示又は助言を行う場合がある。