よむ、つかう、まなぶ。
【資料3】令和元年改正薬機法の検討規定を踏まえた検討状況について(医薬局提出資料)[1.2MB] (6 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_41120.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第16回 7/4)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
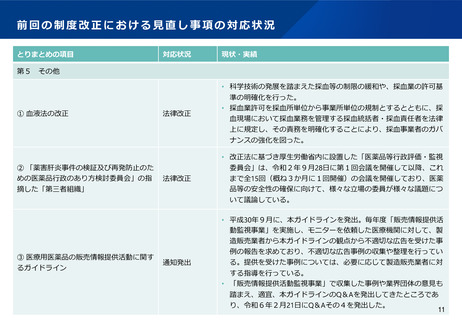
前回の制度改正における見直し事項の対応状況
とりまとめの項目
対応状況
現状・実績
(2) 国際的な整合性のある品質管理手法の導入
① 製造所ごとのGMP・GCTP適合性調査の
導入
② QMS4適合性調査の見直し
③ リスクに応じた品質に係る承認事項の変
更管理手法
• GMP2/GCTP3適合性調査制度について、国際整合の観点から、従来
の製造販売業者による品目ごとの調査申請に加え、製造業者による
品目の区分ごとの適合性調査(区分適合性調査)申請も選択できる
法律改正
制度に見直した。
(※)施行から令和5年度までの区分適合性調査申請件数:30件
(都道府県受付分25件、PMDA受付分5件)※
※国内外のGMP対象施設3,817施設のうち、24施設が利用
法律改正
• ある製造工程について複数の製造所のいずれか(B or C)で実施す
ることで基準確認証の交付を受けた場合、同一製品群に含まれる別
の品目について、当該製造所群のうち一つの製造所(B)で実施す
ることで承認申請する場合に、新規のQMS適合性調査を不要とした。
• 変更計画の確認により変更手続を迅速化する仕組み(いわゆる
法律改正
PACMP)を導入した。
(※)変更計画の確認申請数:医薬品8件、再生医療等製品2件
2 医薬品及び医薬部外品の製造所における製造管理及び品質管理の基準(Good Manufacturing Practiceの略)
3 再生医療等製品の製造所における製造管理及び品質管理の基準(Good Gene, Cellular and Tissue-based Products Manufacturing Practiceの略)
4 医療機器及び体外診断用医薬品の製造販売業者等における製造管理及び品質管理の基準(Quality Management Systemの略)
5
とりまとめの項目
対応状況
現状・実績
(2) 国際的な整合性のある品質管理手法の導入
① 製造所ごとのGMP・GCTP適合性調査の
導入
② QMS4適合性調査の見直し
③ リスクに応じた品質に係る承認事項の変
更管理手法
• GMP2/GCTP3適合性調査制度について、国際整合の観点から、従来
の製造販売業者による品目ごとの調査申請に加え、製造業者による
品目の区分ごとの適合性調査(区分適合性調査)申請も選択できる
法律改正
制度に見直した。
(※)施行から令和5年度までの区分適合性調査申請件数:30件
(都道府県受付分25件、PMDA受付分5件)※
※国内外のGMP対象施設3,817施設のうち、24施設が利用
法律改正
• ある製造工程について複数の製造所のいずれか(B or C)で実施す
ることで基準確認証の交付を受けた場合、同一製品群に含まれる別
の品目について、当該製造所群のうち一つの製造所(B)で実施す
ることで承認申請する場合に、新規のQMS適合性調査を不要とした。
• 変更計画の確認により変更手続を迅速化する仕組み(いわゆる
法律改正
PACMP)を導入した。
(※)変更計画の確認申請数:医薬品8件、再生医療等製品2件
2 医薬品及び医薬部外品の製造所における製造管理及び品質管理の基準(Good Manufacturing Practiceの略)
3 再生医療等製品の製造所における製造管理及び品質管理の基準(Good Gene, Cellular and Tissue-based Products Manufacturing Practiceの略)
4 医療機器及び体外診断用医薬品の製造販売業者等における製造管理及び品質管理の基準(Quality Management Systemの略)
5