よむ、つかう、まなぶ。
【参考資料4】創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会 報告書 (36 ページ)
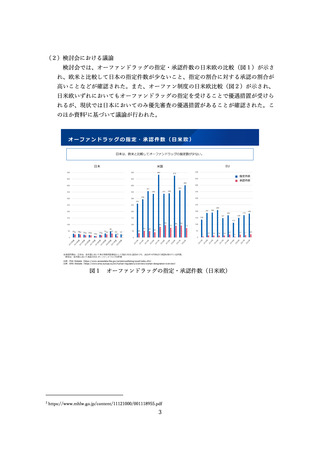
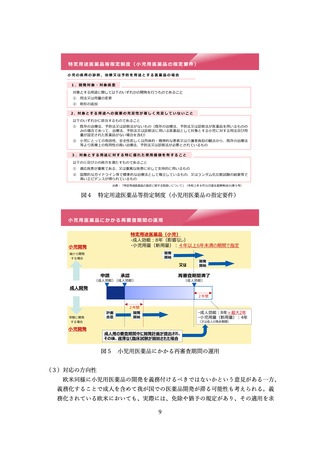
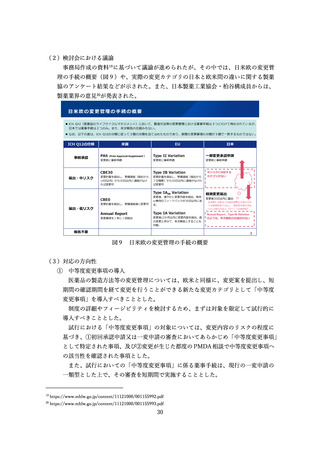
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_41120.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第16回 7/4)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
討を行ってほしい。
○
患者の参画については、患者や疾病ごとに患者団体の体力も違うので、患者が参画
できる環境はしっかり作っていかないと進まない。
○
臨床研究も治験も患者からすれば同じだが、現在は制度的な仕組みが複雑になりす
ぎている。新規モダリティについても、新しいモダリティを一定程度包含した形での
法の立て付けを検討した方がいい。
○
新しいモダリティについては、申請が来てから考えるのではなく、世の中に登場し
た段階で、情報収集して、品質評価や臨床評価のあり方について早めに議論すべき。
○
日本に拠点を持たない米国のバイオテックが必ずしも日本に進出してくるとは限ら
ないため、ドラッグ・ロスの解消のためには、日本に拠点を持つ製薬企業が、そうし
たバイオテックから権利を導入して日本で開発を進めることが重要であり、国内の製
薬企業の積極的な検討に期待したい。
12.おわりに
本検討会では、令和5年6月9日にとりまとめられた「医薬品の迅速・安定供給実現
に向けた総合対策に関する有識者検討会」の報告書において指摘された事項を中心に、
薬事規制のあり方について9回にわたる検討を行い、提言を行った。このうちの一部に
ついては、すでに通知発出等、行政上の対応が行われており、適切に運用されることを
期待するとともに、引き続き詳細な検討が必要な事項については、製薬業界、医療関係
者を始めとする関係者の意見を聴きつつ、引き続き行政において適切に検討を継続する
ことを求めたい。
一方、我が国における創薬力の向上、医薬品の安定供給の確保、ドラッグ・ロスの解
消といった医薬品産業を取り巻く諸課題を解決するためには、本検討会では十分に議論
できなかったものもある。PMDA が果たすべき役割やそのための体制強化のほか、医薬
品の迅速な承認制度のあり方や小児用医薬品の実用化促進のあり方なども含め、薬事制
度に関連する検討課題はまだ残されていると考えられる。この検討会の終了後も、国際
的な創薬環境の変化に取り残されることなく、我が国の患者が迅速に、安全かつ有効な
医薬品の提供を受けられるよう、薬事制度についても不断の見直しが検討されることを
強く望むものである。
36
○
患者の参画については、患者や疾病ごとに患者団体の体力も違うので、患者が参画
できる環境はしっかり作っていかないと進まない。
○
臨床研究も治験も患者からすれば同じだが、現在は制度的な仕組みが複雑になりす
ぎている。新規モダリティについても、新しいモダリティを一定程度包含した形での
法の立て付けを検討した方がいい。
○
新しいモダリティについては、申請が来てから考えるのではなく、世の中に登場し
た段階で、情報収集して、品質評価や臨床評価のあり方について早めに議論すべき。
○
日本に拠点を持たない米国のバイオテックが必ずしも日本に進出してくるとは限ら
ないため、ドラッグ・ロスの解消のためには、日本に拠点を持つ製薬企業が、そうし
たバイオテックから権利を導入して日本で開発を進めることが重要であり、国内の製
薬企業の積極的な検討に期待したい。
12.おわりに
本検討会では、令和5年6月9日にとりまとめられた「医薬品の迅速・安定供給実現
に向けた総合対策に関する有識者検討会」の報告書において指摘された事項を中心に、
薬事規制のあり方について9回にわたる検討を行い、提言を行った。このうちの一部に
ついては、すでに通知発出等、行政上の対応が行われており、適切に運用されることを
期待するとともに、引き続き詳細な検討が必要な事項については、製薬業界、医療関係
者を始めとする関係者の意見を聴きつつ、引き続き行政において適切に検討を継続する
ことを求めたい。
一方、我が国における創薬力の向上、医薬品の安定供給の確保、ドラッグ・ロスの解
消といった医薬品産業を取り巻く諸課題を解決するためには、本検討会では十分に議論
できなかったものもある。PMDA が果たすべき役割やそのための体制強化のほか、医薬
品の迅速な承認制度のあり方や小児用医薬品の実用化促進のあり方なども含め、薬事制
度に関連する検討課題はまだ残されていると考えられる。この検討会の終了後も、国際
的な創薬環境の変化に取り残されることなく、我が国の患者が迅速に、安全かつ有効な
医薬品の提供を受けられるよう、薬事制度についても不断の見直しが検討されることを
強く望むものである。
36