よむ、つかう、まなぶ。
【参考資料4】創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会 報告書 (7 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_41120.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第16回 7/4)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
(4)検討会後の対応状況
検討会の議論を踏まえ、次の通知を発出した。
・「希少疾病用医薬品等の指定に関する取扱いについて」の一部改正について(令
和 6 年 1 月 16 日医薬薬審発 0116 第1号、医薬機審発 0116 第1号厚生労働省医
薬局医薬品審査管理課長、厚生労働省医薬局医療機器審査管理課長連名通知)
・希少疾病用医薬品の指定に関する取扱いについての質疑応答集(Q&A)につい
て(令和 6 年 1 月 16 日厚生労働省医薬局医薬品審査管理課事務連絡)
・「優先審査等の取扱いについて」の一部改正について(令和 6 年 1 月 16 日医薬薬
審発 0116 第2号、医薬機審発 0116 第2号厚生労働省医薬局医薬品審査管理課長、
厚生労働省医薬局医療機器審査管理課長連名通知)
・「再審査期間の取扱いについて」の一部改正について(令和 6 年 1 月 16 日医薬薬
審発 0116 第3号厚生労働省医薬局医薬品審査管理課長通知)
また、令和 6 年度予算事業により小児・希少疾病用医薬品等薬事相談センターを
PMDA 内に設置し、希少疾病用医薬品に関する相談体制を強化する予定 。
3.小児用医薬品の開発促進に資する薬事審査等のあり方
(1)背景
小児用医薬品の開発は、日本だけでなく国際的にも、市場規模が小さいことや治験
実施の困難さ(症例集積性、コスト)等の理由から、一般的に開発が進みにくいこと
が指摘されている。近年拡大が懸念されている「ドラッグ・ロス」の問題においても、
特に、希少疾病用とともに、小児用のドラッグ・ロスが課題となっている。これまで、
我が国では、特定用途医薬品指定制度の創設、再審査期間の運用見直し等(小児に対
応した治験環境の整備や薬価上の措置を含む。)の対応を進めてきたが、更なる取組
による小児用医薬品の開発促進が求められている。
欧米では、その対策の一つとして、成人の医薬品開発時に小児用医薬品の開発計画
策定を義務づける等の取組を行っている。欧米の制度を参考にしつつ、我が国の状況
も踏まえながら、小児用医薬品開発を成人用と同時に進めるための仕組みや、その実
効性を高めるための対応を検討した。
(2)検討会における議論
検討会では、従来行われていた小児用医薬品の開発を促進するための施策として、
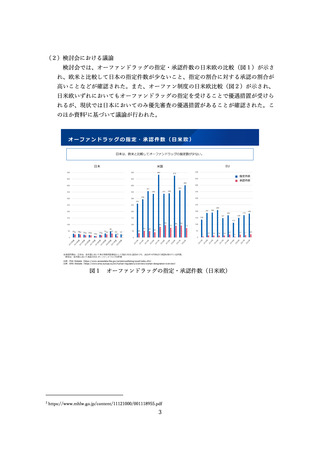
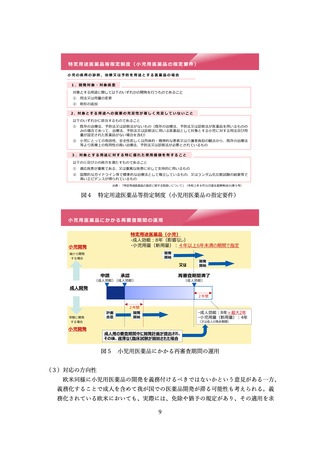
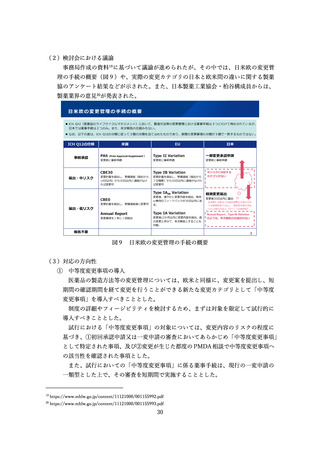
特定用途医薬品指定制度(図3、4)や、再審査期間の運用(図5)について紹介さ
れた。このほか資料3に基づいて議論が行われた。
また、参考人として出席した令和4年度厚生労働科学特別研究「小児がん及び小児
希少難治性疾患に係る医薬品開発の推進制度に資する調査研究」の研究代表者(東京
3
https://www.mhlw.go.jp/content/11121000/001118959.pdf
7
検討会の議論を踏まえ、次の通知を発出した。
・「希少疾病用医薬品等の指定に関する取扱いについて」の一部改正について(令
和 6 年 1 月 16 日医薬薬審発 0116 第1号、医薬機審発 0116 第1号厚生労働省医
薬局医薬品審査管理課長、厚生労働省医薬局医療機器審査管理課長連名通知)
・希少疾病用医薬品の指定に関する取扱いについての質疑応答集(Q&A)につい
て(令和 6 年 1 月 16 日厚生労働省医薬局医薬品審査管理課事務連絡)
・「優先審査等の取扱いについて」の一部改正について(令和 6 年 1 月 16 日医薬薬
審発 0116 第2号、医薬機審発 0116 第2号厚生労働省医薬局医薬品審査管理課長、
厚生労働省医薬局医療機器審査管理課長連名通知)
・「再審査期間の取扱いについて」の一部改正について(令和 6 年 1 月 16 日医薬薬
審発 0116 第3号厚生労働省医薬局医薬品審査管理課長通知)
また、令和 6 年度予算事業により小児・希少疾病用医薬品等薬事相談センターを
PMDA 内に設置し、希少疾病用医薬品に関する相談体制を強化する予定 。
3.小児用医薬品の開発促進に資する薬事審査等のあり方
(1)背景
小児用医薬品の開発は、日本だけでなく国際的にも、市場規模が小さいことや治験
実施の困難さ(症例集積性、コスト)等の理由から、一般的に開発が進みにくいこと
が指摘されている。近年拡大が懸念されている「ドラッグ・ロス」の問題においても、
特に、希少疾病用とともに、小児用のドラッグ・ロスが課題となっている。これまで、
我が国では、特定用途医薬品指定制度の創設、再審査期間の運用見直し等(小児に対
応した治験環境の整備や薬価上の措置を含む。)の対応を進めてきたが、更なる取組
による小児用医薬品の開発促進が求められている。
欧米では、その対策の一つとして、成人の医薬品開発時に小児用医薬品の開発計画
策定を義務づける等の取組を行っている。欧米の制度を参考にしつつ、我が国の状況
も踏まえながら、小児用医薬品開発を成人用と同時に進めるための仕組みや、その実
効性を高めるための対応を検討した。
(2)検討会における議論
検討会では、従来行われていた小児用医薬品の開発を促進するための施策として、
特定用途医薬品指定制度(図3、4)や、再審査期間の運用(図5)について紹介さ
れた。このほか資料3に基づいて議論が行われた。
また、参考人として出席した令和4年度厚生労働科学特別研究「小児がん及び小児
希少難治性疾患に係る医薬品開発の推進制度に資する調査研究」の研究代表者(東京
3
https://www.mhlw.go.jp/content/11121000/001118959.pdf
7