よむ、つかう、まなぶ。
資 料 2-1 血液製剤に関する医療機関からの感染症報告事例等について (6 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_42777.html |
| 出典情報 | 薬事審議会 血液事業部会 安全技術調査会(令和6年度第1回 8/30)、運営委員会(第2回 8/30)(合同会議)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
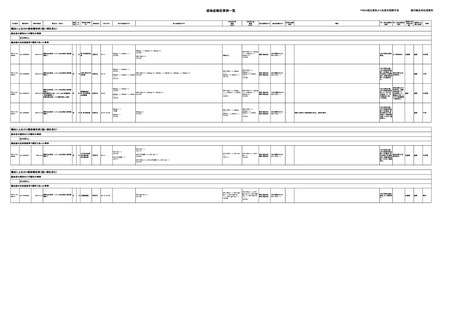
感染症報告事例一覧
識別番号
AA-23000049
AA-24000002
報告受領日
2024/3/7
2024/4/11
販売名(一般名)
患者
性別
献血グロベニン-I(乾
燥ポリエチレングリコー
男
ル処理人免疫グロブリ
ン)
献血グロベニン-I(乾
燥ポリエチレングリコー
男
ル処理人免疫グロブリ
ン)
年代
原疾患(簡
略名)
80 -
80 -
感染症名
投与年月
B型肝炎表面抗
23/11
体陽性
B型肝炎表面抗
体陽性
23/10
B型肝炎コア抗
体陽性
投与後検査(年月)
投与前検査(年月)
-
抗HBs抗原(-)
(23/10)
抗HBs抗体が上昇した。
(不明日)
一過性に抗HBs抗体、抗HBc抗体が陽性となった。抗HBs抗体(89(正常値<10))、抗
HBc抗体(1.2(正常値<1.0))。
(23/10)
抗HBs抗体、抗HBc抗体が陰性化。
(23/12)
患者 受血者
原料血漿・製品NAT検査(再検査・製造
検体 個別
時検査の別)
確保
NAT
-
-
PMDA提出資料より血液対策課作成
併用血液製剤等
備考
ロット番号
同一製剤ロット使用状況
国内血漿分画製剤
重篤性(担
当医の見
解)
重篤性(企
業の見解)
転帰
-
該製品に使用されている原料血漿は、
日本赤十字社でHBVに対して血清学的
検査及びNAT試験により陰性であること
が確認されている国内献血由来の血漿
を原料としており、献血者個別の原料血
漿に関して入荷時にも適合であることを
確認している。また、製造段階ではプー ル血漿に対してもNAT試験によりHBV
が陰性であること確認しており、出荷時
にも最終製品に関してNAT試験により
HBVが陰性であることを確認し、試験に
適合しているもののみ市場に供給され
ている。
545357、
539906
-
-
非重篤
不明
-
当該製品に使用されている原料血漿
は、日本赤十字社でHBVに対して血清
学的検査及びNAT試験により陰性であ
ることが確認されている国内献血由来
の血漿を原料としており、献血者個別の
原料血漿に関して入荷時にも適合であ
ることを確認している。また、製造段階 ではプール血漿に対してもNAT試験に
よりHBVが陰性であること確認してお
り、出荷時にも最終製品に関してNAT試
験によりHBVが陰性であることを確認
し、試験に適合しているもののみ市場に
供給されている。
当該製品は製造工程でエタノール分画、ポリエチレングリコール処理、イオン交換体処理、
ウイルス除去膜処理によりウイルスの不活化や除去処理が行われており、医薬発第 1047
号 血漿分画製剤のウイルスに対する安全性確保に関するガイドライン、医薬審第 329号 541025
ヒト又は動物細胞株を用いて製造されるバイオテクノロジー応用医薬品のウイルス安全性
評価に従い評価されたウイルスクリアランス指数は9以上であることを確認している。
-
非重篤
非重篤
軽快
軽快
5
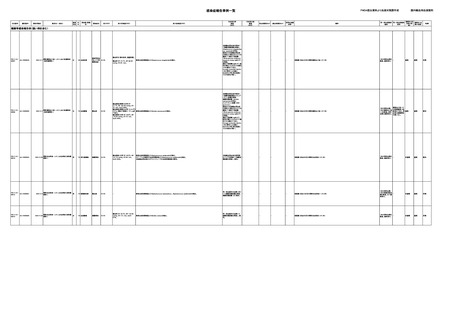
識別番号
AA-23000049
AA-24000002
報告受領日
2024/3/7
2024/4/11
販売名(一般名)
患者
性別
献血グロベニン-I(乾
燥ポリエチレングリコー
男
ル処理人免疫グロブリ
ン)
献血グロベニン-I(乾
燥ポリエチレングリコー
男
ル処理人免疫グロブリ
ン)
年代
原疾患(簡
略名)
80 -
80 -
感染症名
投与年月
B型肝炎表面抗
23/11
体陽性
B型肝炎表面抗
体陽性
23/10
B型肝炎コア抗
体陽性
投与後検査(年月)
投与前検査(年月)
-
抗HBs抗原(-)
(23/10)
抗HBs抗体が上昇した。
(不明日)
一過性に抗HBs抗体、抗HBc抗体が陽性となった。抗HBs抗体(89(正常値<10))、抗
HBc抗体(1.2(正常値<1.0))。
(23/10)
抗HBs抗体、抗HBc抗体が陰性化。
(23/12)
患者 受血者
原料血漿・製品NAT検査(再検査・製造
検体 個別
時検査の別)
確保
NAT
-
-
PMDA提出資料より血液対策課作成
併用血液製剤等
備考
ロット番号
同一製剤ロット使用状況
国内血漿分画製剤
重篤性(担
当医の見
解)
重篤性(企
業の見解)
転帰
-
該製品に使用されている原料血漿は、
日本赤十字社でHBVに対して血清学的
検査及びNAT試験により陰性であること
が確認されている国内献血由来の血漿
を原料としており、献血者個別の原料血
漿に関して入荷時にも適合であることを
確認している。また、製造段階ではプー ル血漿に対してもNAT試験によりHBV
が陰性であること確認しており、出荷時
にも最終製品に関してNAT試験により
HBVが陰性であることを確認し、試験に
適合しているもののみ市場に供給され
ている。
545357、
539906
-
-
非重篤
不明
-
当該製品に使用されている原料血漿
は、日本赤十字社でHBVに対して血清
学的検査及びNAT試験により陰性であ
ることが確認されている国内献血由来
の血漿を原料としており、献血者個別の
原料血漿に関して入荷時にも適合であ
ることを確認している。また、製造段階 ではプール血漿に対してもNAT試験に
よりHBVが陰性であること確認してお
り、出荷時にも最終製品に関してNAT試
験によりHBVが陰性であることを確認
し、試験に適合しているもののみ市場に
供給されている。
当該製品は製造工程でエタノール分画、ポリエチレングリコール処理、イオン交換体処理、
ウイルス除去膜処理によりウイルスの不活化や除去処理が行われており、医薬発第 1047
号 血漿分画製剤のウイルスに対する安全性確保に関するガイドライン、医薬審第 329号 541025
ヒト又は動物細胞株を用いて製造されるバイオテクノロジー応用医薬品のウイルス安全性
評価に従い評価されたウイルスクリアランス指数は9以上であることを確認している。
-
非重篤
非重篤
軽快
軽快
5