よむ、つかう、まなぶ。
資料2-3:省令改正について (4 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_43236.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第36回 9/4)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
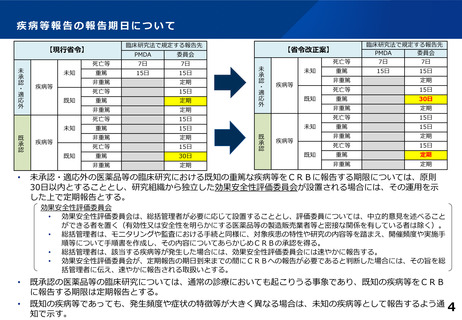
疾病等報告の報告期日について
臨床研究法で規定する報告先
【現行省令】
未
承
認
・
適
応
外
未知
疾病等
既知
未知
既
承
認
•
疾病等
既知
PMDA
委員会
死亡等
7日
7日
重篤
15日
15日
非重篤
定期
死亡等
15日
重篤
定期
非重篤
定期
死亡等
15日
重篤
15日
非重篤
定期
死亡等
15日
重篤
30日
非重篤
定期
【省令改正案】
死亡等
未
承
認
・
適
応
外
未知
疾病等
既知
未知
既
承
認
疾病等
既知
重篤
臨床研究法で規定する報告先
PMDA
委員会
7日
7日
15日
15日
非重篤
定期
死亡等
15日
重篤
30日
非重篤
定期
死亡等
15日
重篤
15日
非重篤
定期
死亡等
15日
重篤
定期
非重篤
定期
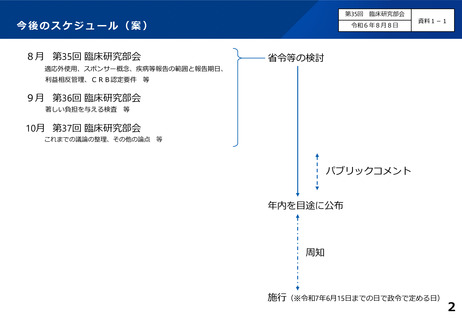
未承認・適応外の医薬品等の臨床研究における既知の重篤な疾病等をCRBに報告する期限については、原則
30日以内とすることとし、研究組織から独立した効果安全性評価委員会が設置される場合には、その運用を示
した上で定期報告とする。
効果安全性評価委員会
•
効果安全性評価委員会は、総括管理者が必要に応じて設置することとし、評価委員については、中立的意見を述べること
ができる者を置く(有効性又は安全性を明らかにする医薬品等の製造販売業者等と密接な関係を有している者は除く)。
•
総括管理者は、モニタリングや監査における手続と同様に、対象疾患の特性や研究の内容等を踏まえ、開催頻度や実施手
順等について手順書を作成し、その内容についてあらかじめCRBの承認を得る。
•
総括管理者は、該当する疾病等が発生した場合には、効果安全性評価委員会には速やかに報告する。
•
効果安全性評価委員会が、定期報告の期日到来までの間にCRBへの報告が必要であると判断した場合には、その旨を総
括管理者に伝え、速やかに報告される取扱いとする。
•
•
既承認の医薬品等の臨床研究については、通常の診療においても起こりうる事象であり、既知の疾病等をCRB
に報告する期限は定期報告とする。
既知の疾病等であっても、発生頻度や症状の特徴等が大きく異なる場合は、未知の疾病等として報告するよう通
4
知で示す。
臨床研究法で規定する報告先
【現行省令】
未
承
認
・
適
応
外
未知
疾病等
既知
未知
既
承
認
•
疾病等
既知
PMDA
委員会
死亡等
7日
7日
重篤
15日
15日
非重篤
定期
死亡等
15日
重篤
定期
非重篤
定期
死亡等
15日
重篤
15日
非重篤
定期
死亡等
15日
重篤
30日
非重篤
定期
【省令改正案】
死亡等
未
承
認
・
適
応
外
未知
疾病等
既知
未知
既
承
認
疾病等
既知
重篤
臨床研究法で規定する報告先
PMDA
委員会
7日
7日
15日
15日
非重篤
定期
死亡等
15日
重篤
30日
非重篤
定期
死亡等
15日
重篤
15日
非重篤
定期
死亡等
15日
重篤
定期
非重篤
定期
未承認・適応外の医薬品等の臨床研究における既知の重篤な疾病等をCRBに報告する期限については、原則
30日以内とすることとし、研究組織から独立した効果安全性評価委員会が設置される場合には、その運用を示
した上で定期報告とする。
効果安全性評価委員会
•
効果安全性評価委員会は、総括管理者が必要に応じて設置することとし、評価委員については、中立的意見を述べること
ができる者を置く(有効性又は安全性を明らかにする医薬品等の製造販売業者等と密接な関係を有している者は除く)。
•
総括管理者は、モニタリングや監査における手続と同様に、対象疾患の特性や研究の内容等を踏まえ、開催頻度や実施手
順等について手順書を作成し、その内容についてあらかじめCRBの承認を得る。
•
総括管理者は、該当する疾病等が発生した場合には、効果安全性評価委員会には速やかに報告する。
•
効果安全性評価委員会が、定期報告の期日到来までの間にCRBへの報告が必要であると判断した場合には、その旨を総
括管理者に伝え、速やかに報告される取扱いとする。
•
•
既承認の医薬品等の臨床研究については、通常の診療においても起こりうる事象であり、既知の疾病等をCRB
に報告する期限は定期報告とする。
既知の疾病等であっても、発生頻度や症状の特徴等が大きく異なる場合は、未知の疾病等として報告するよう通
4
知で示す。