よむ、つかう、まなぶ。
03【資料1-1】ワクチンの研究開発について(予防接種基本計画)[2.1MB] (9 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_44241.html |
| 出典情報 | 厚生科学審議会 予防接種・ワクチン分科会 予防接種基本方針部会(第63回 10/10)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
ワクチンの研究開発に係るこれまでの議論における主なご意見
第35回予防接種基本方針部会(令和元年11月)
• 薬事承認のときに評価される項目と、定期接種化のときに評価される項目が違うものがあり、疾病負荷のデータなど、新たに
薬事承認後にデータを取らないといけないような状況が生じる場合がある。
• 疾病負荷等のデータとなると、ナショナルデータベース等、大規模な研究を実施しなければ根拠のあるデータが取れないところも
あり、データ取得に際し、薬事承認後から2、3年を要する場合がある。
第22回研究開発及び生産・流通部会(令和元年12月)
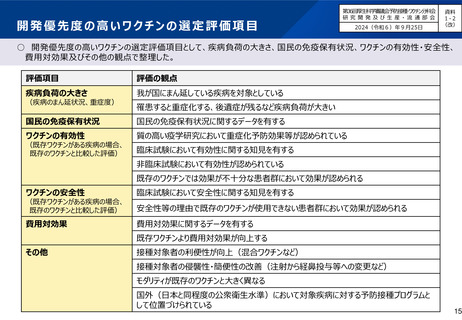
• 開発優先度の高いワクチンとなるための基準や開発する企業のメリットを明確にして欲しい。
• 定期接種化に必要なデータというのは国際的にも明らかであり、そのワクチンがカバーする疾病負荷、有効性、安全性、費用
対効果である。これらのデータが不十分なままでは、ワクチン評価に関する小委員会での議論が十分にできないこともあり、特に、
開発優先度の高いワクチンについては、薬事承認より前の早い段階から検討すべき。
第32回研究開発及び生産・流通部会(令和5年5月)
• 開発優先度の高いワクチンの認定基準を明確にして、定期化の対応等の見直しが行われることが望ましい。
• 今後、開発優先度の高いワクチンは見直しをすべきであり、それに関してどのように情報収集するか取りまとめるべき。
9
第35回予防接種基本方針部会(令和元年11月)
• 薬事承認のときに評価される項目と、定期接種化のときに評価される項目が違うものがあり、疾病負荷のデータなど、新たに
薬事承認後にデータを取らないといけないような状況が生じる場合がある。
• 疾病負荷等のデータとなると、ナショナルデータベース等、大規模な研究を実施しなければ根拠のあるデータが取れないところも
あり、データ取得に際し、薬事承認後から2、3年を要する場合がある。
第22回研究開発及び生産・流通部会(令和元年12月)
• 開発優先度の高いワクチンとなるための基準や開発する企業のメリットを明確にして欲しい。
• 定期接種化に必要なデータというのは国際的にも明らかであり、そのワクチンがカバーする疾病負荷、有効性、安全性、費用
対効果である。これらのデータが不十分なままでは、ワクチン評価に関する小委員会での議論が十分にできないこともあり、特に、
開発優先度の高いワクチンについては、薬事承認より前の早い段階から検討すべき。
第32回研究開発及び生産・流通部会(令和5年5月)
• 開発優先度の高いワクチンの認定基準を明確にして、定期化の対応等の見直しが行われることが望ましい。
• 今後、開発優先度の高いワクチンは見直しをすべきであり、それに関してどのように情報収集するか取りまとめるべき。
9