よむ、つかう、まなぶ。
【参考資料2】医薬品等行政評価・監視委員会の概要等 (4 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_47693.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第18回 12/23)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
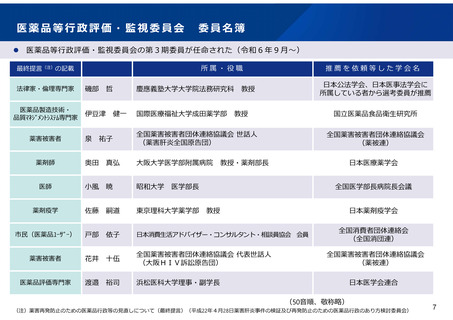
医薬品等行政評価・監視委員会において主に取り扱う事項
評価・監視委員会では主に、①医薬局からの定期報告、②委員の求めに応じた薬事制度等の各種施策の確認・評価、
③委員の求めに応じた個別事項への対応、④評価・監視委員会の意見・勧告に係る対応、を取り扱う。
項目
具体的な内容の例
安全性確保のプロセスが適正に行われているかを確認するための情報
① 製造販売承認された新医薬品の情報(該当品目の一覧表)
(1)医薬局からの定期報告
(報告対象)先駆的医薬品指摘制度(先駆け審査指定制度)/条件付き承認制度/特例承認制度/緊
急承認制度の対象品目、海外未承認の品目
② 市販後の安全性情報の収集・評価の状況
(報告対象)緊急安全性情報、添付文書の改訂内容等
③ 海外における安全対策の措置状況(国内での対応状況を含む)
(報告対象)安全性の懸念による販売中止、回収、医療従事者向けの情報提供等
(2)委員の求めに応じた薬
事制度等の各種施策の
確認・評価
特定の医薬品や領域に限定されない、薬事全般に関する事項
(3)委員の求めに応じた個
別事項への対応
特定の医薬品や領域に関する事項
(4)評価・監視委員会の意
見・勧告に係る対応
評価・監視委員会の意見・勧告のとりまとめ
(5)その他
(例)市販後安全対策や承認審査に関する制度・施策
薬害肝炎検証・検討委員会の最終提言への対応状況
など
(例)新型コロナウイルスの治療薬・ワクチンの安全対策、後発医薬品の製造管理及び品質管理
評価・監視委員会の意見・勧告を受けた施策の実施状況の評価
評価・監視委員会が自ら行う海外調査(欧米の薬事制度、個別医薬品の承認状況等)
評価・監視委員会の運営規程
(例)利益相反、審議参加規定等
(注)個別の医薬品等の有効性及び安全性に関する最終的な評価は、従来通り、薬事審議会が行う。
4
評価・監視委員会では主に、①医薬局からの定期報告、②委員の求めに応じた薬事制度等の各種施策の確認・評価、
③委員の求めに応じた個別事項への対応、④評価・監視委員会の意見・勧告に係る対応、を取り扱う。
項目
具体的な内容の例
安全性確保のプロセスが適正に行われているかを確認するための情報
① 製造販売承認された新医薬品の情報(該当品目の一覧表)
(1)医薬局からの定期報告
(報告対象)先駆的医薬品指摘制度(先駆け審査指定制度)/条件付き承認制度/特例承認制度/緊
急承認制度の対象品目、海外未承認の品目
② 市販後の安全性情報の収集・評価の状況
(報告対象)緊急安全性情報、添付文書の改訂内容等
③ 海外における安全対策の措置状況(国内での対応状況を含む)
(報告対象)安全性の懸念による販売中止、回収、医療従事者向けの情報提供等
(2)委員の求めに応じた薬
事制度等の各種施策の
確認・評価
特定の医薬品や領域に限定されない、薬事全般に関する事項
(3)委員の求めに応じた個
別事項への対応
特定の医薬品や領域に関する事項
(4)評価・監視委員会の意
見・勧告に係る対応
評価・監視委員会の意見・勧告のとりまとめ
(5)その他
(例)市販後安全対策や承認審査に関する制度・施策
薬害肝炎検証・検討委員会の最終提言への対応状況
など
(例)新型コロナウイルスの治療薬・ワクチンの安全対策、後発医薬品の製造管理及び品質管理
評価・監視委員会の意見・勧告を受けた施策の実施状況の評価
評価・監視委員会が自ら行う海外調査(欧米の薬事制度、個別医薬品の承認状況等)
評価・監視委員会の運営規程
(例)利益相反、審議参加規定等
(注)個別の医薬品等の有効性及び安全性に関する最終的な評価は、従来通り、薬事審議会が行う。
4