よむ、つかう、まなぶ。
【資料1】医薬品の安定供給について (5 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_51428.html |
| 出典情報 | 医療用医薬品の安定確保策に関する関係者会議(第20回 2/17)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
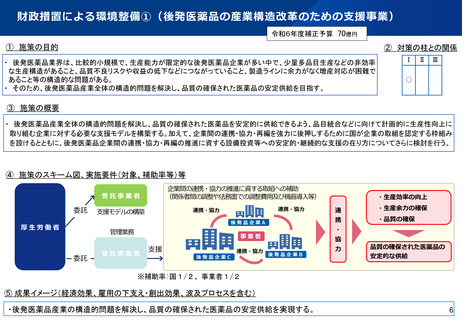
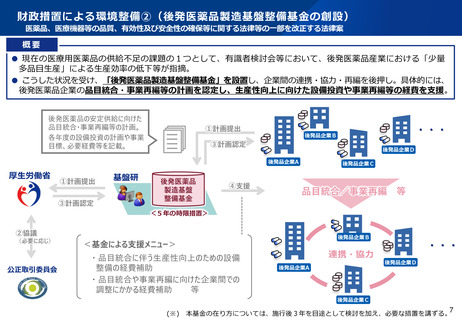
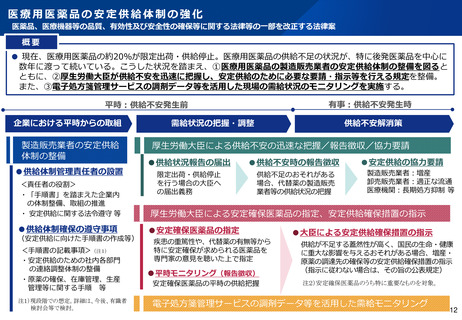
医療用医薬品の品目統合に伴う薬事手続きの迅速化について
令和7年2月14日付けで「医療用医薬品の品目統合等に伴う製造方法等の変更手続に係る手続の迅速化について」
(医薬品審査管理課長、監視指導・麻薬対策課長連名通知)を発出
通知の趣旨
後発医薬品の品目統合等を加速させるため、一定期間、既承認品目(鑑となる品目)と製造所、製造方法等を同じにする(製造を集約
する)ための変更を行う場合の薬事手続きについて、標準的事務処理期間を「1.5ヶ月」とする特例を設ける(通常の申請:6ヶ月)。
通知の概要
1.適用対象
医療用医薬品(化成品に限り、体外診断用医薬品を除く。)であり、以下の①または①②にあてはまるもの。なお、小分け製造に係る
新規承認申請(以下単に「代替新規申請」という。)を行う場合に限り、この申請が可能。
① 既承認の医療用医薬品について、鑑となる品目と製造方法等を同一の内容に変更するもの。例えば、ある製造販売業者(A社)の後
発品Aについて、その製造方法等を、異なる製造販売業者(B社)の後発品B(後発品Aと有効成分、規格等が同一な「鑑となる品
目」)と同一とする(揃える)ための申請を行おうとする場合。
② ①に伴い、後発品Aについて造粒工程のスケールを変更せず、造粒工程のバッチを重ねる又は造粒品のバッチを分割することにより
その後の混合及び打錠の工程のスケールのみを変更するもの。なお、鑑となる後発品Bについても同様のスケール変更を行いたい場
合にあっては、軽微変更届によりそれを行ってもよいこと。
<変更品目>
<鑑品目>
2.必要な手続等
• 標準的事務処理期間は「1.5ヶ月」とすること
• 製造方法等を既承認品目(鑑となる品目)と完全に一致させることを前
提に同等性の資料の提出は求めないこと
• GMP調査は当該申請時には不要だが、次回調査申請時には調査権者に本
通知適用品目である旨申告すること
• 令和7年4月1日から申請受付開始
3.その他
① 販売名の変更は求めないこと
② 変更前品目の切替は使用期限満了までとし、その後は承認整理すること
③ 含量違いの互換性の確認は原則行わないこと
④ 手数料は後発医薬品代替新規申請(適合性調査なし)とすること
品目A
製法A
(処方A)
品目A
製法B
(処方B)
①鑑品目に製法等
を合わせる
+
②バッチ重ねの
スケール増
②鑑品目も
スケール増
品目B
製法B
(処方B)
品目B
製法B
(処方B)
5
令和7年2月14日付けで「医療用医薬品の品目統合等に伴う製造方法等の変更手続に係る手続の迅速化について」
(医薬品審査管理課長、監視指導・麻薬対策課長連名通知)を発出
通知の趣旨
後発医薬品の品目統合等を加速させるため、一定期間、既承認品目(鑑となる品目)と製造所、製造方法等を同じにする(製造を集約
する)ための変更を行う場合の薬事手続きについて、標準的事務処理期間を「1.5ヶ月」とする特例を設ける(通常の申請:6ヶ月)。
通知の概要
1.適用対象
医療用医薬品(化成品に限り、体外診断用医薬品を除く。)であり、以下の①または①②にあてはまるもの。なお、小分け製造に係る
新規承認申請(以下単に「代替新規申請」という。)を行う場合に限り、この申請が可能。
① 既承認の医療用医薬品について、鑑となる品目と製造方法等を同一の内容に変更するもの。例えば、ある製造販売業者(A社)の後
発品Aについて、その製造方法等を、異なる製造販売業者(B社)の後発品B(後発品Aと有効成分、規格等が同一な「鑑となる品
目」)と同一とする(揃える)ための申請を行おうとする場合。
② ①に伴い、後発品Aについて造粒工程のスケールを変更せず、造粒工程のバッチを重ねる又は造粒品のバッチを分割することにより
その後の混合及び打錠の工程のスケールのみを変更するもの。なお、鑑となる後発品Bについても同様のスケール変更を行いたい場
合にあっては、軽微変更届によりそれを行ってもよいこと。
<変更品目>
<鑑品目>
2.必要な手続等
• 標準的事務処理期間は「1.5ヶ月」とすること
• 製造方法等を既承認品目(鑑となる品目)と完全に一致させることを前
提に同等性の資料の提出は求めないこと
• GMP調査は当該申請時には不要だが、次回調査申請時には調査権者に本
通知適用品目である旨申告すること
• 令和7年4月1日から申請受付開始
3.その他
① 販売名の変更は求めないこと
② 変更前品目の切替は使用期限満了までとし、その後は承認整理すること
③ 含量違いの互換性の確認は原則行わないこと
④ 手数料は後発医薬品代替新規申請(適合性調査なし)とすること
品目A
製法A
(処方A)
品目A
製法B
(処方B)
①鑑品目に製法等
を合わせる
+
②バッチ重ねの
スケール増
②鑑品目も
スケール増
品目B
製法B
(処方B)
品目B
製法B
(処方B)
5